一、细胞株开发在药物开发过程中的重要性
细胞株开发在治疗性重组蛋白工艺开发过程中是非常重要的一个环节,直接影响了整个药物开发的质量和速度。而中国仓鼠卵巢(CHO)细胞是生物制品工业生产中最常用的哺乳动物宿主细胞系,得益于其能相对简单地将外源重组蛋白稳定地导入宿主细胞基因组上。从20世纪80年代开始首次使用CHO细胞作为表达宿主,稳定的基因组整合几乎都是通过随机整合的方式实现。
二、新技术的出现
由于当时缺乏有效可行的技术,随机整合已成为生产稳定CHO细胞系产品的金标准。然而随着越来越多数据的积累和验证,CHO细胞的不稳定成为细胞株开发过程中不小的挑战和风险。
近年来,新的、高效的(半)定点整合技术为细胞株开发领域注入了新的活力。这些先进的方法包括转座酶、重组酶、核酸酶介导的位点特异性基因组整合技术,能将目的基因特定地插入到细胞基因组内的转录活性区。
三、整合技术介绍
1、随机整合
传统的细胞株开发采用随机整合的方法,即质粒进入细胞后随机整合到宿主细胞的基因组上。其优点是通过转染加压筛选后,可能会得到表达量较高的细胞株。但它的缺点也很明显,由于是随机、非受控整合,质粒整合的位置、方向和拷贝数是不可控的,需要很大的筛选基数才能得到较高产量的细胞株,而且筛选的细胞株表型和遗传学特征差异大,需要大量的培养工艺优化和验证。下图是使用传统随机整合方法构建稳转单克隆细胞株的流程图。

由于随机整合方法筛选细胞株是一项费时和费力的工程。为了加速开发进度,提高筛选出表型和遗传性质更稳定细胞株的概率。科学家们已经开发了许多提高筛选效率和通量的分析预测方法,同时借助高通量先进设备有效缩短细胞株开发周期。如Aebischer-Gumy等人描述了一种基于选择性剪接的适应性细胞表面展示技术,可在单细胞水平上对分泌产物进行定性和定量的预测。通过增加一些元件,如弱的剪接受体位点、TM区域等构建能在细胞表面分泌蛋白的表达框架(选择性剪接载体,AS)。
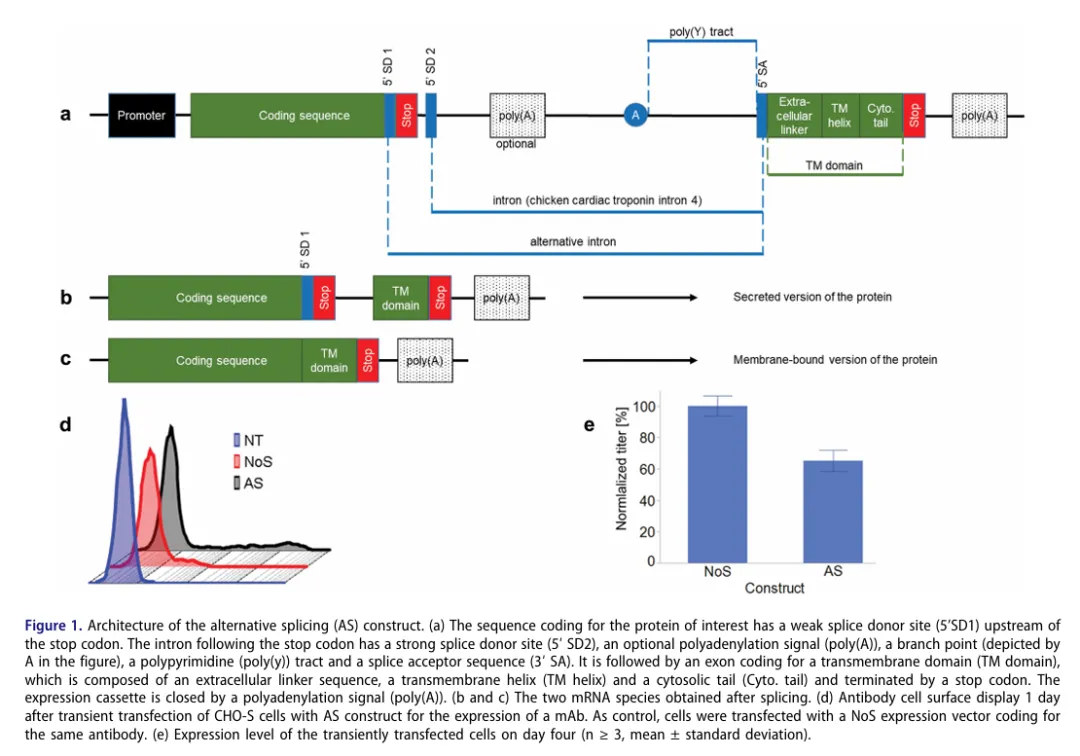
使用表达双特异性抗体的AS表达质粒,稳转筛选细胞株,细胞表面染色后,通过流式检测分析发现不同分群的细胞与Fed-batch评估后不同表达量和质量的细胞株有很大的关联,以达到对分泌产物的表达量和质量的提前预测。

虽然随机整合方法仍广泛应用于生产重组CHO细胞系产品,但很多未知的不确定性及对CHO细胞的了解十分有限,更为理性化的设计是细胞株开发技术未来发展趋势。而定点靶向整合是细胞株理性化设计的基础。
2、转座酶介导的半定点整合
经过了过去几年的发展,更可控的定点整合技术已经取得了很大的进步。其中一种高效转座酶介导的半定点整合系统已经应用于CHO细胞株开发领域。

转座酶介导的半定点整合是一种由特定的转座子和转座酶结合,以靶向方式将外源DNA引入细胞基因组的技术。转座子是在原核和真核生物基因组上可以进行位置转换的DNA片段,它的侧翼区含有能被转座酶识别的反向末端重复序列(ITR)。由于操作简便高效,且对宿主细胞和培养基无特别要求。现在有一些已用于生物制药研发的商业化转座酶系统,包括Sleeping Beauty, Leap-In,PiggyBac,DirectedLuck等。

1) Sleeping Beauty转座系统来源于硬骨鱼Tc1/mariner转座子超家族。大多数Tc1样元件分为斑马鱼、鲑鱼和非洲蟾蜍等3个主要类型的转座元件。对来自于不同鱼类基因组的有缺陷的拷贝序列比对,获得了最原始的转座子序列,通过点突变获得有活性的转座子元件,命名为Sleeping Beauty。
SB转座系统主要包括转座酶合成基因和能够被转座酶识别的具有反向重复序列的转座元件。一对反向重复序列(IRs)包含转座酶结合位点,转座酶的结合位点是一段正向重复序列(DRs),称为IR/DR。转座酶由DNA结合结构域、转座催化结构域和核定位性号(NLS)组成。这两个组成部分同时存在SB才能发生转座。转座酶识别转座子内的反向重复序列并结合,在转座酶亚基的相互作用下两端的重复序列元件发生配对、结合,形成突触复合体。在转座酶的作用下发生供体的剪切,转座元件的目标位置重新整合。

基于SB转座系统,目的基因替换转座酶的编码区,转座酶在含有合适的启动子的单独载体上也可以表达,能很大程度提高稳转细胞池的表达量。

2) Leap-In转座酶系统属于PiggyBac转座子超家族,由非洲爪蛙(Leap-In 1)和家蚕转座子(Leap-In 2)改造而来。使用Leap-In 1转座子已经在细胞株筛选中有很好的表现,转染后能高效快速地得到高表达、较均一的细胞池,相比传统的随机整合,细胞池的产量和产品质量与克隆有更好的可比性,且单克隆表现出更好的表型和遗传稳定性。
3) 另外一种广泛应用于研究阶段的是PiggyBac转座酶系统。最早是1983年由Fraser等在杆状病毒侵染粉纹夜蛾TN-368细胞系时首次分离得到的一种转座子。由于其在基因组中的插入位点无明显的偏好性,PB转座系统被广泛应用于昆虫、鱼类、哺乳动物等多种生物的基础研究中。
PB转座子两端各有一个反向末端重复序列(ITR),中间编码一个长594个氨基酸的PB转座酶。根据转座酶的转录方向区分转座子的两个末端,两端最外侧各有长13bp并对称的ITR,内侧各有一段间隔区,但不对称,再靠内侧是各长19bp且对称的亚末端反向重复序列(Sub-TIR)。

构建双组分的转座子载体系统,一个是在转座酶上下游分别添加启动子和PolyA序列,另外一个供体质粒由目的基因,两端包含反向末端重复序列。两种质粒共转染至宿主细胞后,PB转座酶表达后从供体质粒上切除由ITR构成的目的基因表达框。随后转座子载体稳定插入到基因组中后结束转座过程。

由于PB转座子系统倾向于在基因组中富含A+T的区域插入,而基因组中含很多TTAA位点,所以其转染效率很高,可以携带很大片段的外源基因,且在目标基因组中可以长期稳定表达,被广泛用于基础研究中。但是传统的PB转座系统是通过向细胞中转染质粒实现的,编码PB酶的质粒有一定几率会整合到基因组上,持续表达PB酶,而通过转染PB酶的mRNA来代替质粒可以有效减少基因毒性。
上海领康时代(www.lktime.cn)目前已搭建基于转座酶系统的稳转细胞株筛选体系,能在4-6周内快速制备高产蛋白用于早期药物研究,较传统随机整合筛选的细胞池在表达量和质量方法有很明显的优势。下图展示的是转染后表达某个重组亚单位疫苗的细胞生长和表达结果,3种不同组合的转座酶半定点整合系统(STI)筛选的细胞池恢复时间比随机整合(RTI)快,表达量高出5-20倍。



虽然转座酶系统较随机整合有明显的优势,但是这种插入位点的不可控性也有一些弊端。基于随机整合和半定点整合的技术,越来越多使用重组酶、定点核酸酶的靶向基因编辑技术,用于细胞株的定点整合,以实现稳定和可预测的基因表达,从而缩短细胞株开发周期,减少大量的筛选工作。
参考文献
[1] Transposon vector-mediated stable gene transfer for the accelerated establishment of recombinant mammalian cell pools allowing for high-yield production of biologics. Biotechnol Lett. 2020; 42(7): 1103-1112.
[2] Rapid recombinant protein production from piggyBac transposon-mediated stable CHO cell pools. J Biotechnol. 2015 Apr 20:200:61-9.
[3] The new frontier in CHO cell line development: From random to targeted transgene integration technologies. Biotechnol Adv. 2024 Oct:75:108402.
[4] piggyBac转座系统的发展及应用. J Development Med. July 2018, Vol.6, No.3.
[5] SPLICELECT™: an adaptable cell surface display technology based on alternative splicing allowing the qualitative and quantitative prediction of secreted product at a single-cell level. Mabs. 2020; 12(1).
[6] Sleeping Beauty Transposition. Microbiol Spectr. 2015; 3(2): MDNA3-0042-2014.
[7] Accelerating and de‐risking CMC development with transposon‐derived manufacturing cell lines. Biotechnol Bioeng. 2021; 118(6): 2301-2311.











