抗体偶联药物(ADC)因其定点偶联、靶向杀灭病原体且不影响正常健康的细胞与组织的优势,而为医学界所重视,国内布局该类药物的企业众多,其药物质量也因此成为业界关注的重点。
保罗·埃尔利希(Paul Ehrlich)凭借着非凡的想象力,在1903年提出了“魔法子弹”(Magic Bullet)的概念:药物可以特异性地到达预定的细胞结构靶点上,并且药物上的靶向分子(子弹)可以有效地杀灭病原体,但不影响正常健康的细胞与组织。这一概念可谓是为后续的ADC发展奠定了理论基础。
一、ADC的作用机制
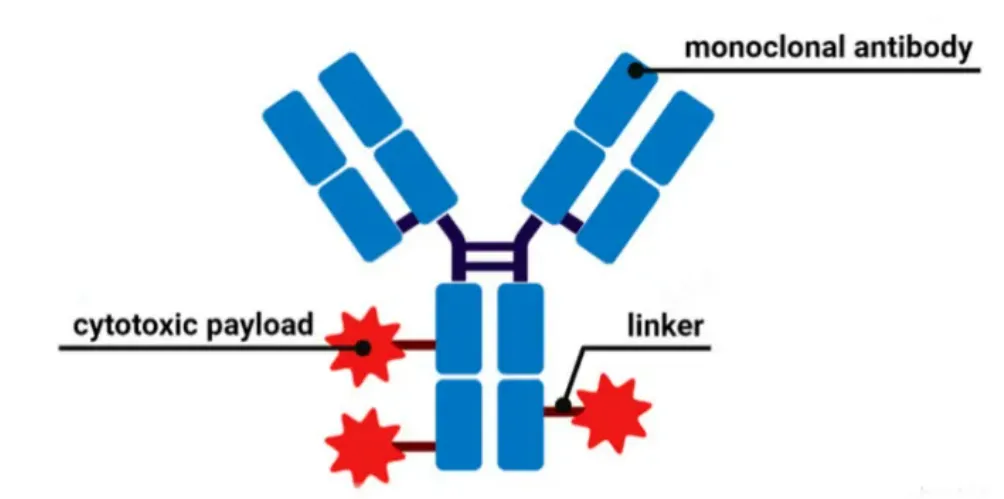
抗体偶联药物(Antibody-Drug Conjugate, ADC)主要由三部分构成:抗体、连接子及细胞毒性分子,如图1所示,是一种由靶向特异性抗原的抗体通过化学连接子与具有强效的细胞毒性分子连接起来的新型癌症治疗药物。
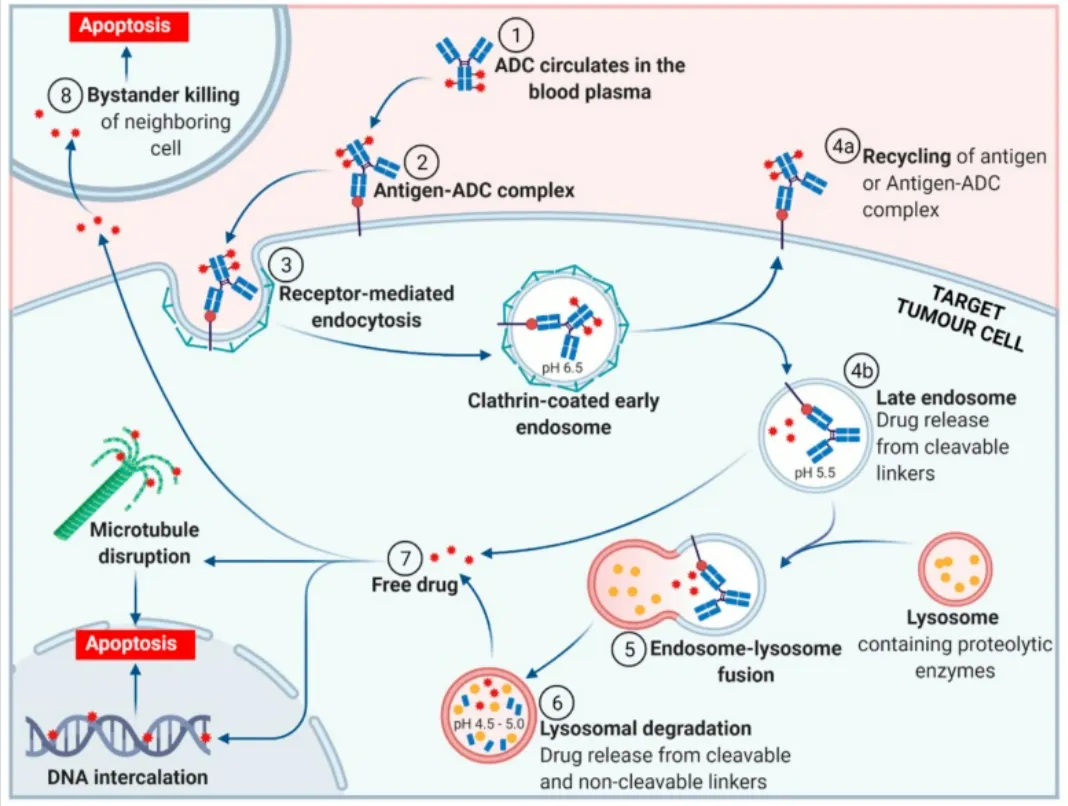
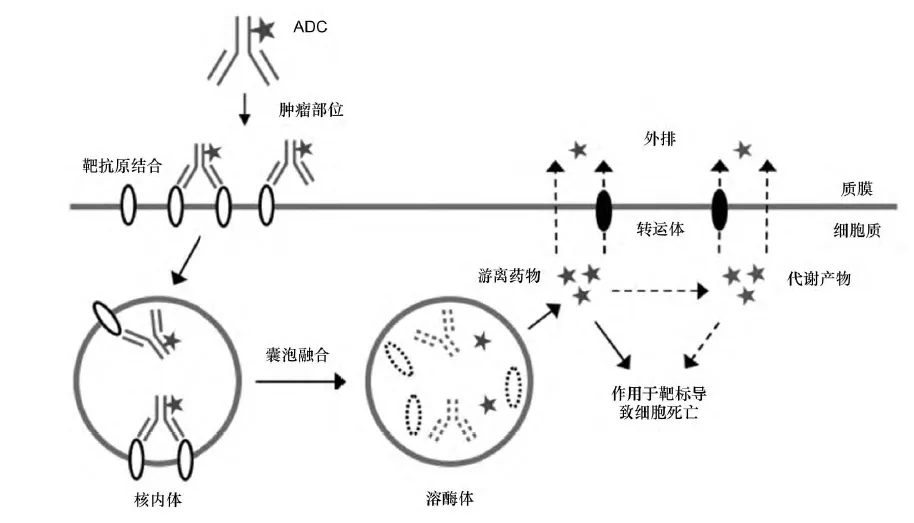
ADC代表性作用机制如图所示
ADC代表性作用机制
A、ADC进入血液循环之后,特异性地识别肿瘤细胞表面上的特定抗原形成ADC-抗原复合物;
B、ADC-抗原复合物内化,通过受体介导的内吞作用形成早期的内体;
C、早期的内体内部,一部分ADC结合FcRn,通过胞转作用重新运输到细胞外,另一部分没有结合FcRn的ADC逐渐发展为成熟晚期内体,对于可裂解的连接子在低pH下释放毒素分子;
D、晚期内体与溶酶体融合后,通过溶酶体中的酶或者相对更酸的环境导致可裂解与不可裂解连接子释放出毒素分子;
E、毒素分子通过靶向DNA或者微管蛋白导致细胞凋亡,另一途径可通过“旁观者效应”杀死附近的癌细胞。
由ADC代表性作用机制中可知,细胞内吞是ADC药物进入细胞内发挥药效的关键步骤。
1、细胞内吞机制
通常来说,抗体不能自由跨膜运输,只能通过以下几种途径进入细胞内部: 网格蛋白介导的细胞内吞、细胞膜穴样凹陷(小窝)介导的内吞、胞饮作用。其中,网格蛋白介导的细胞内吞被认为是绝大多数ADC 发挥药效作用的最重要转运途径。
1.1 网格蛋白介导的细胞内吞
网格蛋白是由3条重链蛋白(相对分子质量约为190,000)和3条与重链蛋白紧密伴随的轻链蛋白(相对分子质量约为25,000)组成的蛋白质复合体,形成3个曲臂,而许多网格蛋白的曲臂部分交织在一起,就形成一个具有5边形网孔的笼子,因此网格蛋白有时也被称为笼形蛋白。
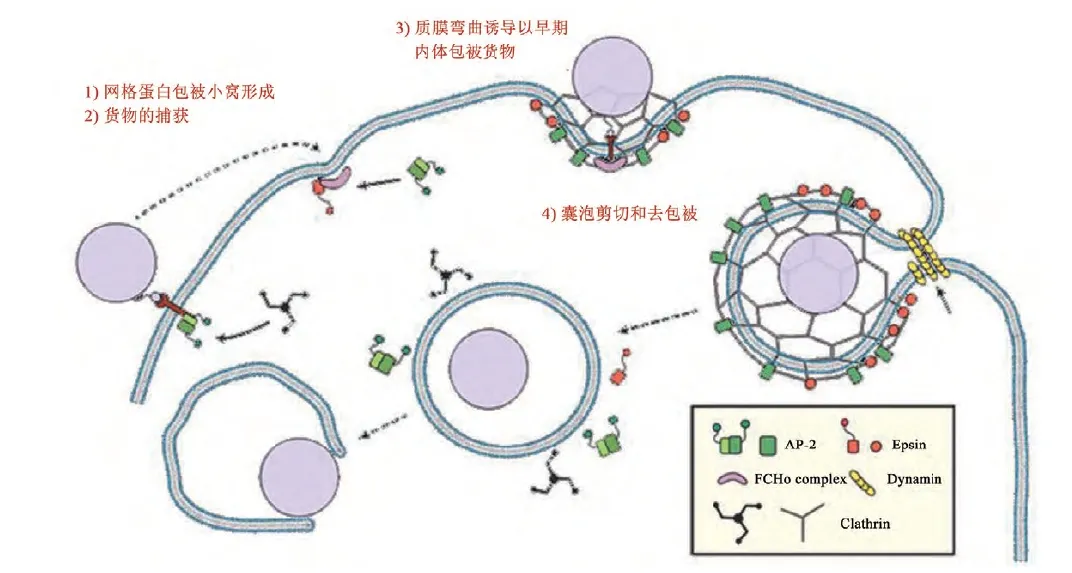
ADC内吞机制示意图
(1)网格蛋白包被小窝的成核化
(2)货物的捕获
(3)弯曲诱导和细胞膜内陷或包被的成长
(4)囊泡剪切和去包被
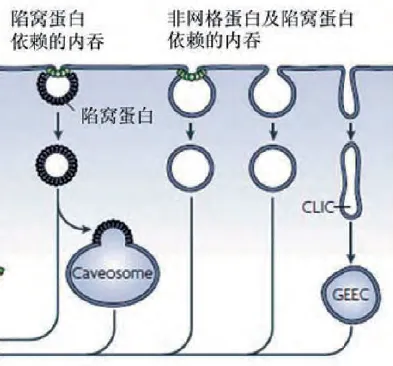
1.2 细胞膜穴样凹陷(小窝)介导的细胞内吞
陷窝蛋白依赖的内吞和非陷窝蛋白依赖的内吞两者的界限不是很明显。细胞膜上的陷窝(caveolae)由胆固醇、鞘脂及蛋白质组成,以陷窝蛋白(caveolae)为标志蛋白。陷窝蛋白是陷窝蛋白依赖的内吞作用中关键性蛋白,是许多信号分子的支架蛋白和负性调节蛋白,属于高度保守的膜蛋白家族。
目前已确定的陷窝蛋白家族成员为陷窝蛋白1、陷窝蛋白2与陷窝蛋白3(caveolin-1, caveolin-2, caveolin-3)。其中前两种分布在非肌肉细胞中起作用,后一种在肌肉细胞中起作用发动蛋白依赖型非网格蛋白依赖的内吞:当内吞形成的小泡即将脱离细胞膜时,发动蛋白被招募到陷窝处,在陷窝颈部装配成环,发动蛋白水解GTP,引起颈部缢缩,最终使小泡脱离质膜。
在非网格蛋白依赖的内吞中,目前发现只有陷窝蛋白依赖的内吞途径需要发动蛋白的参与。非网格蛋白依赖的内吞有效地补充了细胞的内吞途径,与网格蛋白依赖的内吞相比,它是由特定的信号或者是由病原体所触发,有不同的分子机制和动力学模式,将货物输送至细胞特定区域,使细胞更容易适应生存环境。
1.3 胞饮内吞
巨胞饮可以被定义为一过性生长因子诱导的肌动蛋白依赖的内吞过程,主要介导大分子和某些病毒形成大内吞囊泡而进入细胞。巨胞饮是基于富含actin的质膜往外延伸的膜皱褶(ruffles)衍生形成。根据不同的细胞类型和配体的性质,巨胞饮通过actin和微丝驱动,首先形成具有3种结构的细胞膜突起:伪足、圆形膜皱褶和大泡。
巨胞饮内吞具有重要的生理功能。各种颗粒包括细菌、凋亡小体、坏死细胞和病毒等可以诱导不依赖生长因子的膜皱褶形成,与细胞外液共同进入巨胞饮体囊泡中,并进一步被排入酸性囊泡中降解。在免疫防御中,巨胞饮内吞在巨噬细胞和树突状细胞捕获抗原时高度活跃,是抗原捕获的主要途径。巨胞饮内吞还与细胞迁移和肿瘤转移有关。
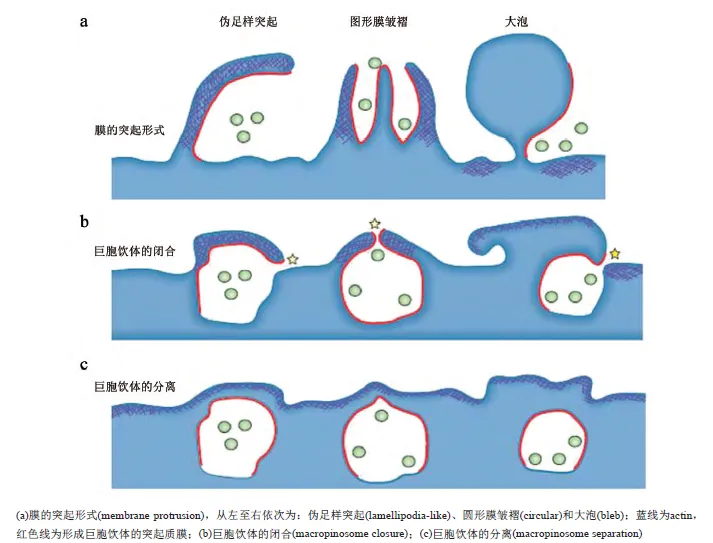
巨胞饮介导的内吞细胞膜突起类型示意图
二、为什么需要评价内吞效果?
下面几个例子可能会有一点启发。
CD33是一种67kD的跨膜糖蛋白受体,通常在正常髓系细胞上表达,因其在AML细胞上会过度表达,因此是吉妥单抗GO的作用靶点。CD33内化受损是吉妥单抗无效的一个重要原因。注射吉妥单抗后3-6小时,取自患者的AML细胞显示仅有25-40%的CD33内化,这种基于体内治疗的内化率与先前在AML细胞系上的体外研究结果一致。
CD30是一种120 kD的跨膜糖蛋白,属于肿瘤坏死因子受体(TNFR)超家族,其胞外部分由六个半胱氨酸结构域(CRD)组成。
本妥昔单抗BV是基于人源化CD30抗体AC10制备的ADC药物,在早期的前临床研究中研究人员证明了该药物的内化作用、与溶酶体的共定位以及较高的细胞毒性作用。此外,CD30被证实会发生网格蛋白介导的内吞作用,因为当细胞被多种类型的CME抑制剂处理时其内化被阻断,而细胞膜窝样内陷介导的内吞抑制剂对胞吞作用无影响。
Trop2是一种46 kD的单体糖蛋白,其肿瘤组织过度表达、组成性内吞作用以及向溶酶体转移等特性使其成为ADC领域一个极具吸引力的靶点。戈沙妥组单抗SG的靶向部分是经过人源化改造的RS7抗体。内化测试实验发现在与肿瘤细胞共培养70分钟后,大约50%的RS7被乳腺癌MDA-MB-468细胞内化,这个比例在肺腺癌Calu-3细胞中更高。此外,相关研究发现与Trop2受体表达水平相比,细胞内吞活性可能与增加肿瘤杀伤效果更有关。
CD22是140kD的跨膜糖蛋白,和CD33一样也是Siglec家族的成员,二者在结构上关键的区别在于CD22比CD33大得多,因为它有多个Ig结构域和ITIM基序。G544是奥加伊妥珠单抗InO的单抗部分,靶向位于N端结构域的A表位。最近报告了一例肿瘤细胞CD22低表达的患者(<正常水平的30%),奥加伊妥珠单抗仍然显示出非常好的响应和生存获益。基于令人印象深刻的数据,即使InO被被回收到细胞表面,但CD22出色的内化活性弥补了这一局限性。
所以大多数ADC药物开发都要依赖于抗体的内吞作用。抗体能否被内化主要由靶点决定,而抗体内化的效率则与抗原密度、抗体亲和力以及抗体与抗原结合表位密切相关。同一靶点的不同抗体也会表现出不同的内化效率。所以,高亲和力、高内化效率的抗体筛选,成为ADC药物靶向性和安全性的重要保证。
下文将介绍各类抗体内吞机制评价方法。
1. 各类抗体内吞机制评价方法优缺点及适用范围:
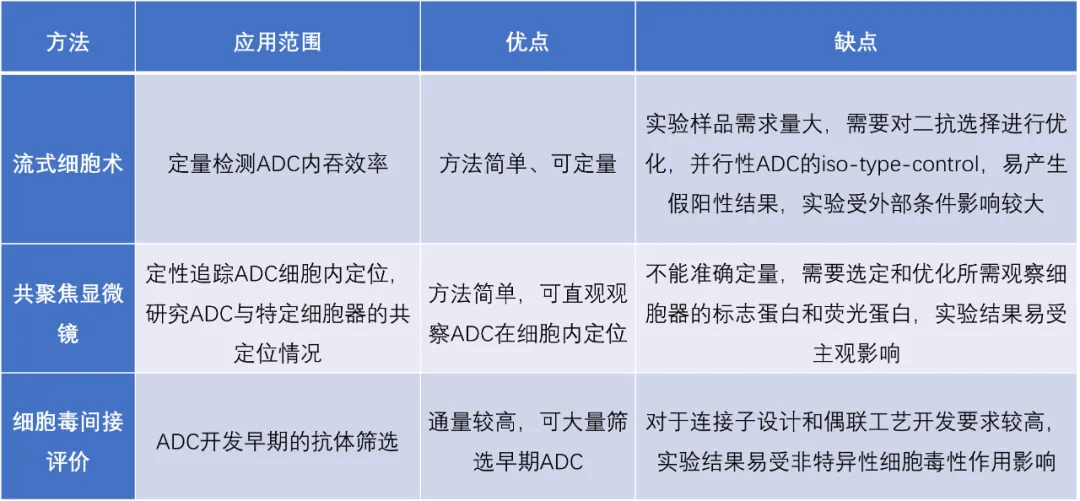
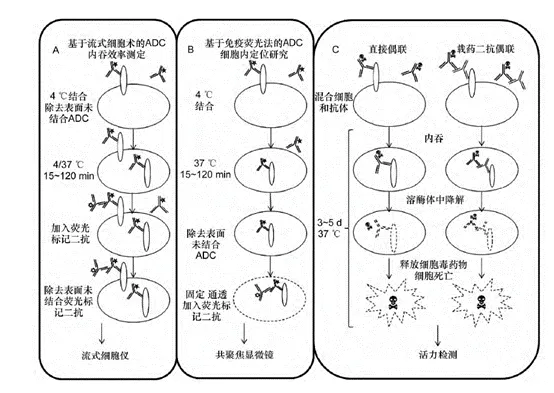
2. 流式细胞术定量测定ADC 内吞效率
该方法通过细胞表面ADC 的减少量间接测定其内吞效率。细胞表面结合抗体的内吞效率通过37℃样品相对于4℃对照样品平均荧光强度(Mean fluorescenceintensity)降低水平得出。即t 时间点的内吞百分比= 100-37℃样品的MFI/4 ℃样品的MFI。
作为成药性研究阶段的重要依据和临床前研究的组成部分,许多研究者用该方法进行了CD30、CD20、CD103、CD19、CD21 靶点的多种ADC 的内吞效率研究,对于这些ADC 品种的开发提供了帮助,是目前最为行之有效的方法。
3. 共聚焦显微镜细胞内定位
共聚焦显微镜定性追踪ADC内吞后定位ADC的药效作用需要其转运至溶酶体中释放出游离小分子发挥作用。因此,直观的追踪ADC转运过程尤为重要。该方法的具体流程如图所示,将ADC与感兴趣的细胞器(或细胞内部物质)标记不同种类的荧光物质,包括具有细胞透过性的细胞器荧光探针、间接免疫染色以及采用荧光标记的抗体结合细胞器的特征性蛋白等。
4. 偶联细胞毒药物间接研究细胞内吞
利用抗体携带细胞毒药物转运进入细胞的能力,研究者们开发了如图所示方法同时筛选大量抗体的内吞能力。其中,常用方法为使用核糖体失活蛋白皂角素偶联的抗多种生物种属的二抗与待测抗体特异性结合后,经受体介导的内吞进入细胞中的皂角素导致细胞死亡,之后通过MTT法或CCK8等方法测定细胞活力,从而间接得到细胞对于该候选抗体的内吞能力大小。该方法具有高通量筛选内吞抗体的同时,为细胞表面一些新的ADC潜在抗原和靶位的发现提供了可靠的手段。直接将抗体与小分子细胞毒药物相连一般作为ADC 抗体筛选的最后部分,研究者开发了能高效地将候选抗体与小分子细胞毒药物相连的方法,该方法可在96 孔板中进行,利用蛋白G 树脂捕获抗体,还原抗体的二硫键暴露连接位点后与小分子细胞毒药物连接,从而筛选抗体的内吞能力。
三、总结
分析靶标受体的内吞作用和ADC的内化,可以极大地促进临床前开发、临床转化和患者治疗效果。显然,内吞作用的效率和随后到溶酶体的路线与ADC靶受体的过表达状态和其他相关参数(如PK)一样重要。大多数ADC研究会展示利用靶标受体内化过程的最低能力以证明ADC在肿瘤细胞内递送有效载荷概念的合理性,这足以证明内吞作用在ADC领域的重要地位以及研究价值。
参考文献
[1] Engineered therapeutic antibodies with improved effector functions[J]. Cancer science. 2009; 100(9): 1566-1572.
[2] In vitro mechanisms of action of rituximab on primary non-Hodgkin lymphomas[J]. Blood. 2003; 101(3): 949-954.
[3] Murphy K, Weaver C. Janeway's immunobiology[M]. Garland Science. 2016.