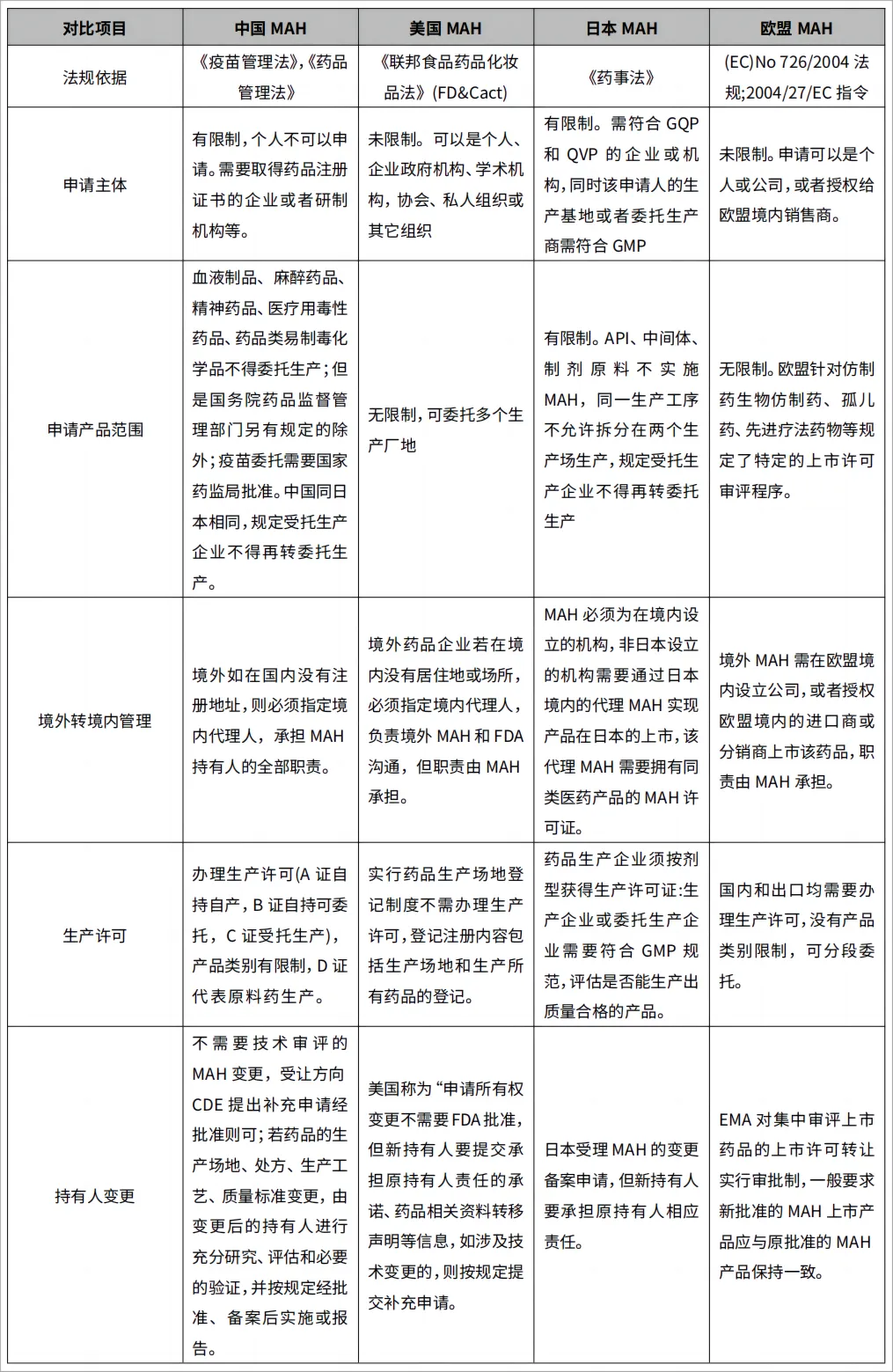
服务资讯 2023-10-26
MAH 制度对于企业的意义在于使得科研个人、研发机构、营销企业等不具备相应生产资质的主体,也可以成为上市许可持有人,这大大刺激了产品研发创新的积极性,有效保护了产品的专利属性,而且也提高了产能利用率,同时药品质量安全主体责任划分更为明确,更加提高了产品的安全性,保护了消费者的健康权益。
一、什么是药品上市许可持有人(MAH)制度
药品上市许可持有人 ( marketing authorization holder,MAH) 制度,是指药品科研机构、科研人员等非生产企业型主体或药品生产企业主体获得药品相关技术,通过药品上市申请成为MAH,MAH可选择自行生产药品或选择委托其他药品生产企业来进行生产。即在该制度下,上市许可持有人和生产许可持有人可以是同一主体,也可以是两个相互独立的主体。但是无论选择哪种方式,MAH 将承担该药品整个生命周期的首要责任。
二、成为药品上市许可持有人(MAH)的先决条件
首先,怎样才能申请MAH,成为MAH的条件是什么?根据新《药品管理法》规定,要想成为药品上市许可持有人(MAH),需要具备以下两种条件:
1、《药品管理法》规定,药品上市许可持有人是指取得药品注册证书的企业或者药品研制机构等,药品上市许可持有人应当建立药品质量保证体系,配备专门人员独立负责药品质量管理。
2、证明自身有责任赔偿等能力。
想成为上市许可持有人(MAH),有两种途径可以申请:
1、将临床阶段的研发产品进行报批,获得批文;
2、通过批文转让, 经过变更药品上市许可持有人程序,从而成为MAH。
四、MAH制度下,医药外包服务 (CXO)
MAH制度最突出优势是将上市许可(药品批准文号持有人)与生产企业相分离,在产品全生命周期的开发阶段、技术转移阶段、商业生产阶段和产品退市四个阶段,MAH的职责范围这么广,那么,全部一定需要持有人自己做吗?不,很多版块的工作也是可以委托外包的。在药品的生命周期中,持有人可在每个阶段分别可将一些相对应的工作外包给第三方公司执行。因此催生出制药全产业链的各式各样的企业,例如临床前的CRO(委托药学研究等)、临床外包的CRO(代理机构)、委托生产CMO(技术转移、委托生产)、研发和生产外包的CDMO(委托研发和商业化生产)、产品上市后的CDO(委托运输及配送)和CPV(委托第三方药物警戒)、委托销售CSO和委托学术推广CPO、委托商务客情的CBO等,还会有委托研发及销售、委托生产及销售、委托仓贮及销售等各种组合委托机构。
五、MAH制度下药品生产的前提条件
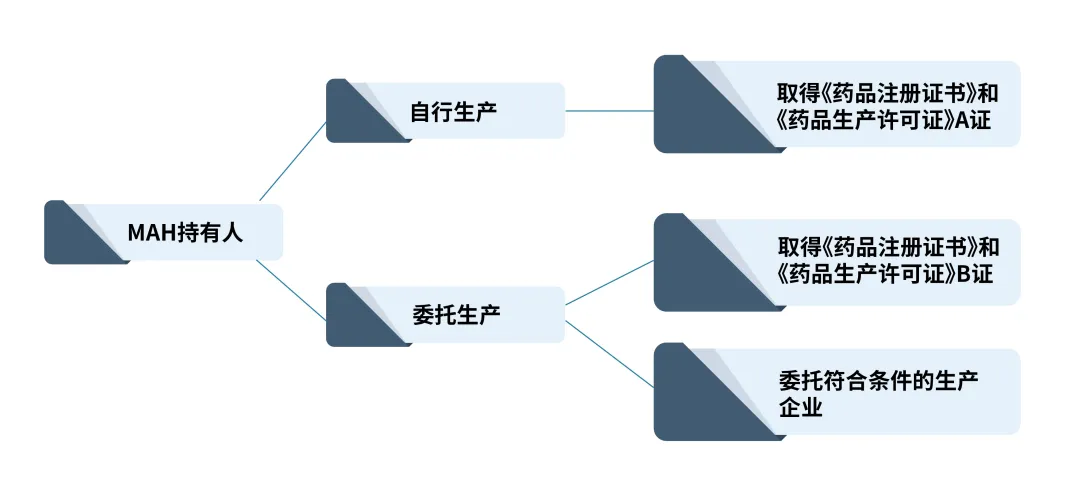
根据2020年7月1日施行的《药品生产监督管理办法》规定,委托他人生产制剂的MAH持有人,并非必须拥有药品生产厂房和设备,仅申请办理《药品生产许可证》即可开展药品生产业务,包括自行生产(A证)和委托生产(B证)。委托生产的MAH需事先与符合条件的药品生产企业签订委托协议和质量协议,将相关协议和实际生产场地申请资料合并提交至MAH持证人所在地省级药监局申请许可。
委托他人生产制剂的MAH持证人,应当具备如下生产条件:
1、有依法经过资格认定的药学技术人员、工程技术人员及相应的技术工人,法定代表人、企业负责人、生产管理负责人(以下称生产负责人)、质量管理负责人(以下称质量负责人)、质量受权人及其他相关人员符合《药品管理法》《疫苗管理法》规定的条件;
2、有能对所生产药品进行质量管理和质量检验的机构、人员;
3、有保证药品质量的规章制度,并符合药品生产质量管理规范要求。
流程如下所示:
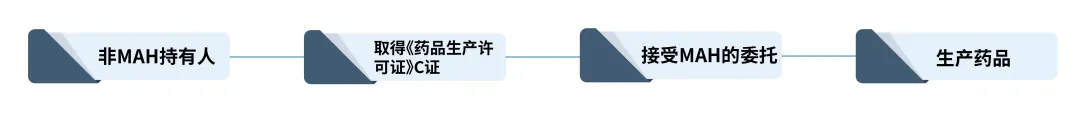
对于非持有人计划生产药品的(如CMO、CDMO企业),则该企业还需要取得《药品生产许可证》C证后,接受持有人的委托方能生产该类药品,流程如下所示:
六、MAH企业委托生产时的生产质量责任清单
根据国家药监局关于发布药品委托生产质量协议指南(2020年版)的公告(2020年 第107号)的要求:为规范药品委托生产,确保药品质量安全,指导、监督药品上市许可持有人(以下简称持有人)和受托药品生产企业(以下简称受托方)履行药品质量保证义务,通过签订药品委托生产质量协议(以下简称质量协议)落实药品管理法律法规及药品生产质量管理规范规定的各项质量责任,保证药品生产全过程持续符合法定要求,责任清单梳理如下:
药品委托生产质量责任清单
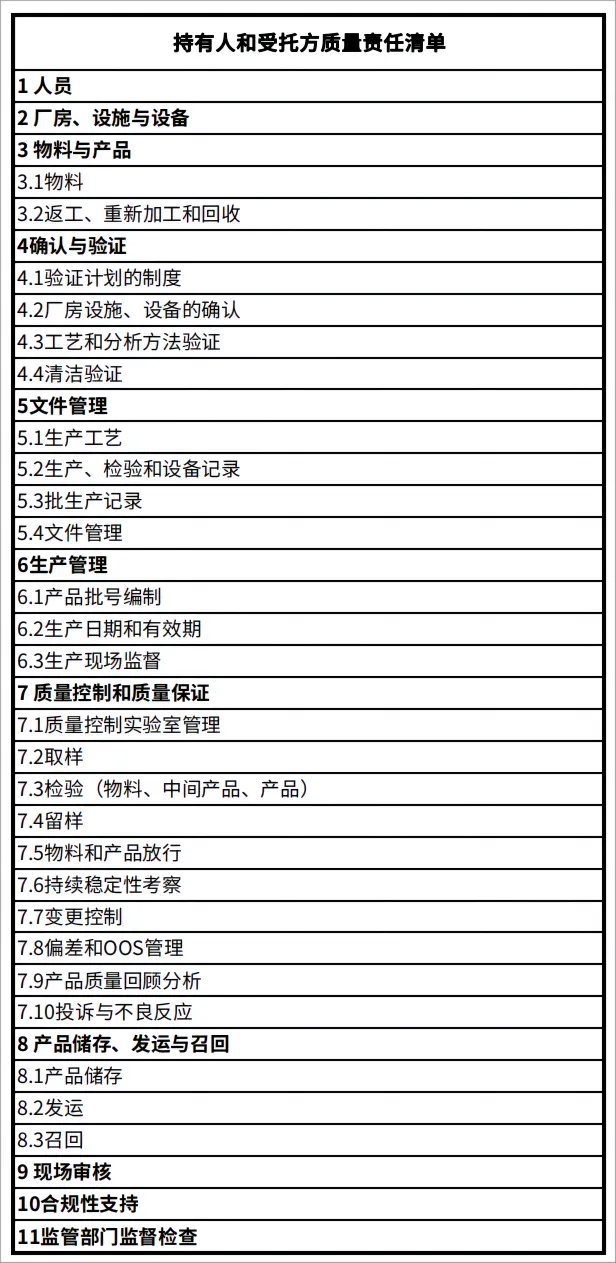
注:持有人和受托方所有责任包括但不限于上述责任清单内容。
七、领康时代在MAH制度下扮演的角色
在药品的全生命周期内,药品上市许可持有人(MAH)可将每个阶段的一些相应工作外包给第三方,领康时代是一站式的合同研究、开发和生产(CDMO)公司,通过一体化生物制药能力和技术赋能平台,提供全方位的端到端服务,帮助合作伙伴发现、开发及生产生物药,实现从概念到商业化生产的全过程,加速全球生物药研发进程,降低研发成本。
领康时代上海研发平台同时具有中试生产及早期临床样品生产服务能力,能够提供从靶点筛选、成药性评估、临床前CMC研究、产品表征和产品质控、临床期间CMC研究、后期临床样品生产、工艺表征/验证、申报资料撰写等一站式生物制品开发过程提供全方位支持。
综上所述,药品上市许可持有人(MAH)是我国向“制药强国”迈进的必然选择,鼓励了新药创新,优化了资源的配置,促进了产业的升级,提升了整体医药行业的竞争力。长远来看,MAH会加速制药行业创新药空前的繁荣和快速发展,加快创新药上市,给中国医药发展创造了一个崭新的环境。
参考文件
1. 《药品管理法》
2. 《疫苗管理法》
3. 《药品生产监督管理办法》
4. 《关于印发药品上市许可持有人制度试点方案的通知》
5. 《联邦食品、药品和化妆品法案》(Federal Food, Drug & Cosmetic Act)
6. 《药事法》(日本)
7. 欧洲议会和理事会条例(EC) No 726/2004
8. 药品委托生产质量协议指南(2020年版)