一、纳米抗体结构
IgG抗体是由轻链和重链组成的Y形结构,其中每条重链含有3个恒定区(CH1/CH2/CH3)和1个可变区(VH),每条轻链含有1个恒定区(CL)和1个可变区 (CL),分子质量一般在150 kDa左右。1993年,比利时科学家在《Nature》杂志上首次报道纳米抗体,一种来源于骆驼科动物体内、天然缺失轻链的重链抗体可变区,分子质量只有15 kDa,蛋白质晶体结构长度为4 nm,直径为2.5 nm,是人类目前为止发现的自然存在的最小的功能性抗原结合片段。
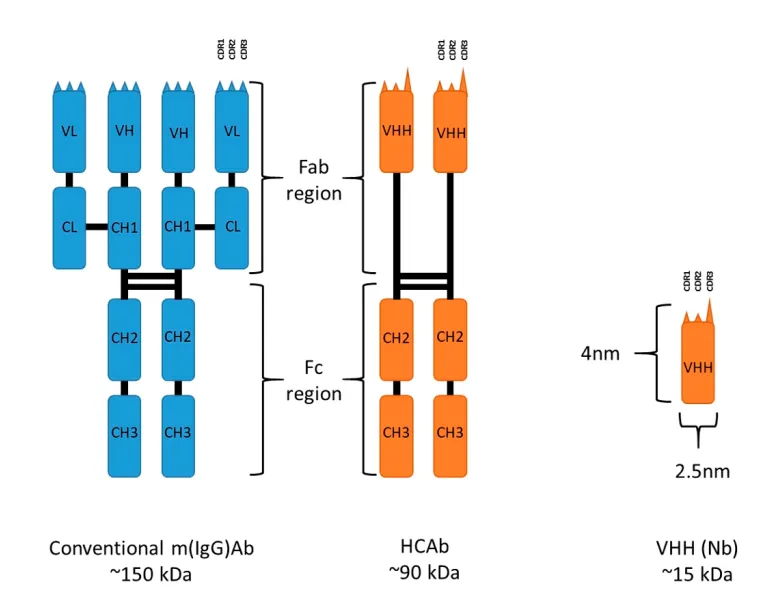
图1 传统抗体、重链抗体、纳米抗体的结构示意图
常规单克隆抗体的VH结构域通常与VL结构域结合,需要总共六个CDR才能表现出完全的抗原结合能力,而VHH仅有三个CDR表现出抗原结合能力。虽然因为VL结构域的缺失导致了较小的互补位,VHH可能结合的抗原范围有限,但是较长的互补决定区CDR1不仅增加了抗原结合位的大小,还可以形成VH结构域中没有的更广的环状结构。另外,VHH的CDR3区较长,人和小鼠抗体VH的CDR3区平均长度为9-12个氨基酸,VHH的CDR3区为16-18个氨基酸,可形成一个特殊的loop环。该loop环可以与蛋白质空间构象上的裂隙和空腔结合,从而能识别空腔和隐蔽的凹形表位如酶活性位点和隐匿病毒表位,有助于预测新的潜在生物靶标及发现新的药理靶点,还可以用作酶的抑制剂、受体的激动剂或拮抗剂。延伸的CDR3区还使纳米抗体的对位表现出凸面对位,而与单克隆抗体的VH-VL结构域通常表现出的凹面或平面对位。
另外,在常规单克隆抗体VH的FR2区,有四个氨基酸参与了与VL的相互作用,这四个氨基酸分别为V37、G44、L45、W47。而在纳米抗体VHH中,这四个氨基酸发生了突变,分别为F(Y)37、E44、R45、G47,这四个位点由疏水性氨基酸残基变化为亲水性氨基酸残基使VHH溶解性更好。还应注意的是,通常观察到FR1区中L11的氨基酸残基替换为S11,这种现象在单峰骆驼VHH序列中比在美洲驼VHH序列中更常见。
人类VH3与骆驼VHH胚系基因具有高度的同源性,因此只需对VHH基因进行较少的改变即可实现抗体人源化,通过基因工程技术获得高亲和力、高特异性、高稳定性的纳米抗体。
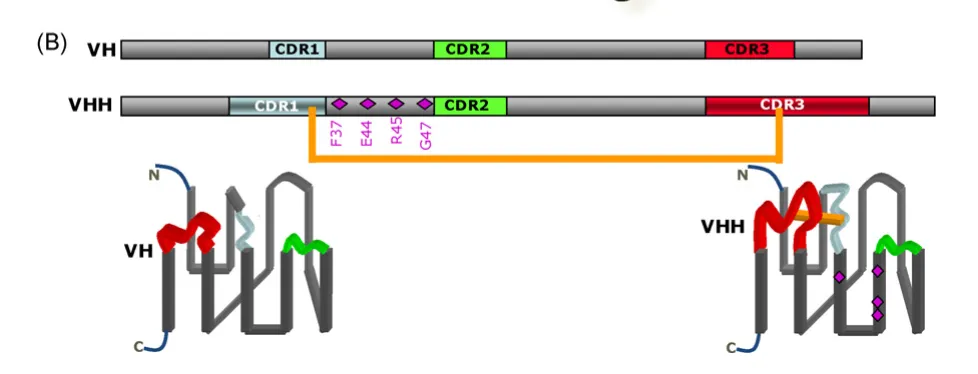
图2 VH和VHH比较
二、纳米抗体优势、缺陷及应用
优 势 :
· 体积小(提高组织和血脑屏障的穿透性)
· 独特的抗原结合表位
· 亲和力高(nM/pM级别的KD)
· 溶解度高
· 热稳定性
· 耐受pH范围更广
· 蛋白酶抗性
· 低免疫原性
· 可组合性强(双价/多价/融合抗体)
· 可利用多种表达系统生产
缺 陷 :
· 单价形式通常需要增加额外的步骤进行修饰
· 小尺寸导致低血清持久性或快速肾脏清除
· 不能发挥与Fc区相关的效应
疾病治疗应用:
· 研究发现,纳米抗体可作为解毒剂与蛇、蝎子、蜘蛛等的毒液发生中和作用或者作为较好的肌毒作用抑制剂;
· 纳米抗体能够高特异性结合致病细菌表面抗原,拮抗细菌对宿主细胞的黏附,可治疗由于耐药菌出现而感染严重的病例;
· 纳米抗体可作为高效的中和剂,已有研究开发了靶向病毒刺突蛋白受体结合区(RBD)的纳米抗体,竞争性地抑制RBD与人血管紧张素转换酶2 (ACE2) 的相互作用并中和病毒;
· 靶向肿瘤和自身免疫性疾病治疗实例。
纳米抗体CAR-T细胞候选物(名为Ciltacabtagene Autoleucel)于2022年2月被FDA批准用于治疗多发性骨髓瘤,其治疗途径是通过开发表达对肿瘤抗原特异的纳米抗体的嵌合抗原受体(CAR)T细胞,从患者体内提取T细胞,并对其进行基因修饰,使其表达肿瘤抗原特异性纳米抗体,然后再回输患者体内。
抗肿瘤抗原的纳米抗体可以与放射性药物结合,以特异性递送至肿瘤,一种用于治疗乳腺癌和胃癌的I-131偶联抗HER2纳米抗体目前正在进行2期临床试验;2018年,卡普拉珠单抗(caplacizumab)被欧盟批准用于治疗获得性血栓性血小板减少性紫癜;靶向白细胞介素-6受体的ALX-0061用于治疗类风湿性关节炎和系统性红斑狼疮,目前处于2期临床试验;2022年9月,靶向肿瘤坏死因子-α的ozoralizumab在日本被批准上市,用于治疗类风湿性关节炎。
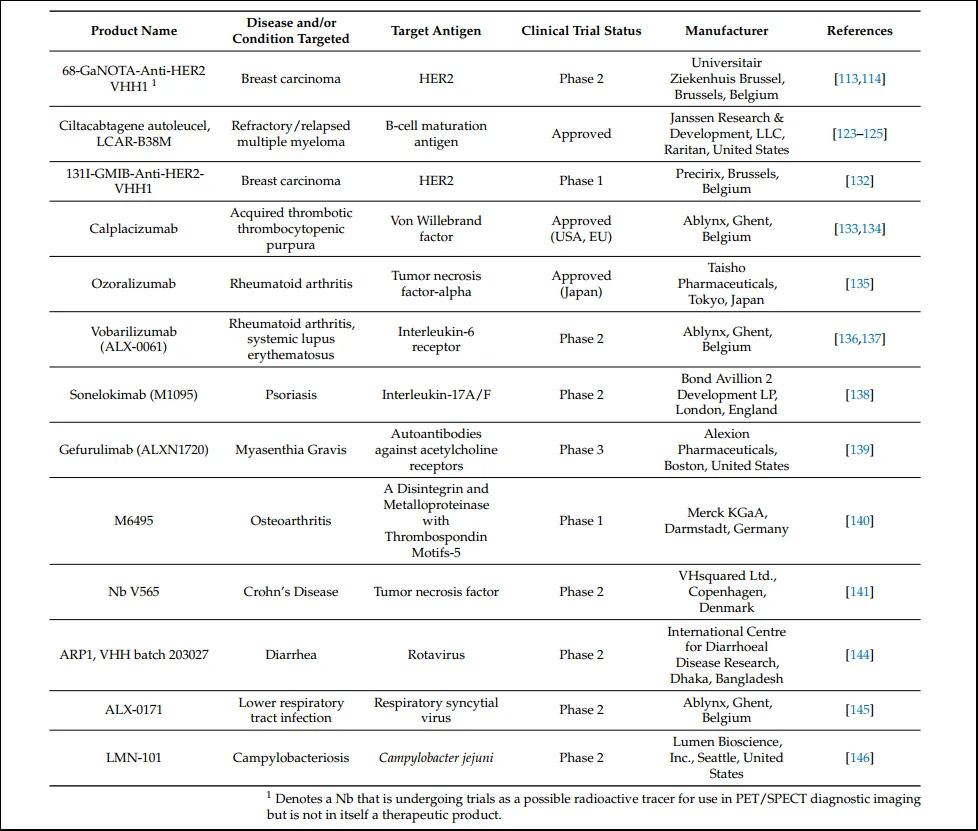
图3 纳米抗体及其相关治疗产品信息(源于参考文献1)
三、纳米抗体制备(免疫文库)
1、噬菌体展示纳米抗体文库构建
获取抗原基因序列, 通过同源重组的方法构建至表达载体,表达抗原并亲和纯化。对骆驼科驯养动物皮下注射进行免疫,免疫结束后, 使用真空采血管采集外周血, 离心分离外周血单个核细胞(peripheral blood mononuclear cells, PBMC)后进行RNA的提取,并进一步反转录生成cDNA, 之后通过两轮PCR扩增VHH片段, 纯化回收VHH片段后, 通过限制性内切酶酶切克隆至噬菌粒载体, 随后将连接产物电转至大肠杆菌中完成特异性针对噬菌体文库的构建。最后, 通过文库库容及VHH片段正确插入率检测进行文库质量评估。
2、噬菌体展示纳米抗体文库筛选
在获得高质量的噬菌体文库后, 运用噬菌体展示技术进行文库筛选, 筛选过程包含“吸附结合-非特异性洗涤-特异性洗脱-富集扩增”4 个阶段。每轮筛选开始, 需要将文库与固相吸附的抗原进行吸附结合, 完成洗涤步骤去除非特异性结合抗原及亲和力低的的噬菌体后, 解离洗脱特异性噬菌体并侵染大肠杆菌进行扩增富集用于下一轮筛选,通过筛选使文库富集。
3、特异性纳米抗体筛选
将噬菌体再次转染到新的大肠杆菌细胞中,使用抗生素作为选择标记,表达抗体。将得到的高细胞结合活性的抗体进行酶联免疫吸附实验(ELISA)检测抗体和抗原的结合能力,测定亲和力常数模拟曲线。通常情况下,平衡解离常数在纳摩尔/皮摩尔范围内是较为理想的数值。
然后对筛选出的纳米抗体进行序列分析。
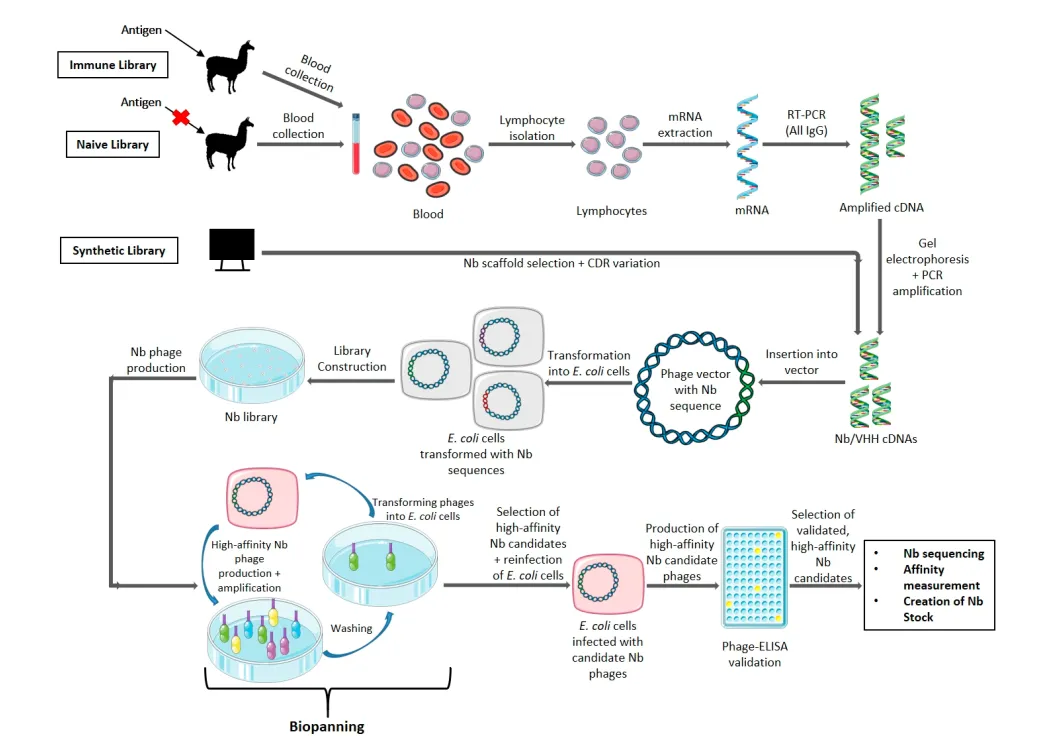
图4 使用噬菌体展示文库产生抗原特异性纳米抗体常规方法的示意图
4、特异性纳米抗体表达
大肠杆菌:目前,周质表达是生产VHH最常用的方法。大肠杆菌周质空间可提供一个氧化环境,促进二硫键的形成,有利于外源蛋白的正确折叠。介导重组蛋白进入周质常用的信号肽有PelB、OmpA、PhoA等。信号肽经信号肽酶切除后,可获得目的蛋白。纳米抗体在周质中的表达量通常较低,为提高纳米抗体在周质的表达水平,可采取纳米抗体与标签蛋白进行融合表达以及和分子伴侣共表达等措施。近年来,商业化的大肠杆菌宿主细胞,包括BL21(DE3)菌株、Rosetta-gami B (DE3)pLysS菌株、Origami 2(DE 3)菌株和Shuffle T7表达已被频繁用于VHH的表达。
酵母:毕赤酵母是甲醇营养型酵母,可利用甲醇作为其唯一碳源。外源蛋白在毕赤酵母胞内表达或分泌至胞外。分泌表达时,毕赤酵母只分泌很少的内源蛋白,外源蛋白是培养基中的主要成分。外源蛋白在毕赤酵母中的糖基化程度与哺乳动物细胞糖基化程度相同,降低了外源蛋白的免疫原性。与酿酒酵母相比,毕赤酵母更适合高密度培养,外源蛋白表达量是酿酒酵母10倍以上,有利于工业化生产。有研究发现,毕赤酵母突变体菌株更适合表达蛋白。目前,毕赤酵母表达纳米抗体,产量可以达到g/L的水平。
哺乳动物细胞:哺乳动物细胞最适合生产治疗性抗体,其产生抗体的免疫原性最小。VHH-Fc在CHO中分批培养的产量可达到100 mg/L。Fc与纳米抗体融合表达,可延长纳米抗体的半衰期,激活其它免疫反应,增强纳米抗体抗病毒的能力,但是,Fc没有提高纳米抗体穿越血脑屏障的能力。
其他:有研究在桥石短芽孢杆菌中表达anti-NDOM-VHH(发酵罐)得到的纳米抗体分泌量高达3g/L;在丝状真菌如米曲霉,昆虫表达系统以及植物表达系统均有产量不低的成功表达研究。
四、小结
自纳米抗体发现以来,由于其具有常规抗体及抗体片段不具备的优势,纳米抗体的研究发展迅速并涉及诊断工具和治疗方法等多个领域,引起了医疗市场的关注。当然,纳米抗体的应用仍需要大量的研究和开发,但在未来的医疗市场开发中一定会发挥着重要的作用。
参考文献
1. A Review of Generation,Diagnostics and Therapeutics. Int. J.Mol. Sci. 2023, 24, 5994.
2. Expression of single-domain antibody in different systems. Appl Microbiol Biotechnol 102, 539–551 (2018).
3. 内吞型EpCAM纳米抗体的筛选及鉴定[J].药学学报, 2020, 55(10):9.DOI:10.16438/j.0513-4870.2020-1359.
4. Camelid immunoglobulins and nanobody technology. Vet Immunol Immunopathol. 2009 Mar 15;128(1-3):178-83.doi:10.1016/j.vetimm.2008.10.299.



