ROR1靶点
1、ROR1的结构和表达
受 体 酪 氨 酸 激 酶 样 孤 儿 受 体 1 ( receptor tyrosine-kinase-like orphan receptor 1,ROR1)是一种跨膜受体,包含细胞外部分、跨膜区和细胞内区域。细胞外部分包括免疫球蛋白样结构域(IG)、富含半胱氨酸结构域(CRD)和Kringle结构域(KD)。CRD通过与配体Wnt5a结合来调节非经典WNT信号传导,KD介导ROR1与其他受体如ROR2的相互作用。
细胞内部分包括一个酪氨酸激酶结构域、两个富含丝氨酸/苏氨酸的结构域和一个富含脯氨酸的结构域,富含脯氨酸的结构域通过募集SH3结构域来激活细胞迁移和增殖信号。富含丝氨酸/苏氨酸的结构域与衔接蛋白发生物理相互作用减少凋亡。
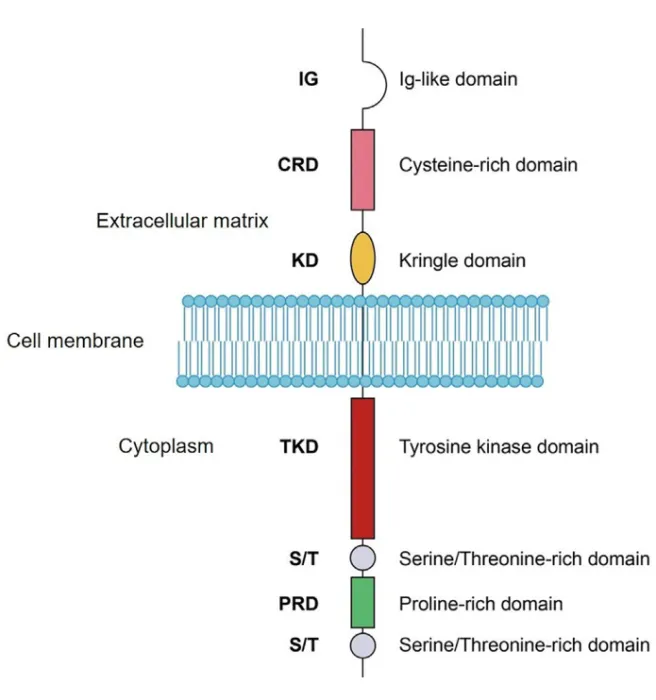
图1 ROR1的结构:ROR1全长937AA,约104.3KD。
2、ROR1在恶性肿瘤中的作用
作为一种癌胚抗原,ROR1在胚胎组织中生理性表达,并在各种血液和实体癌中异常表达,但在大多数产后和成人组织中检测不到,这使其成为癌症治疗,特别是基于抗体的治疗中极具吸引力的靶抗原。ROR1参与对细胞增殖、存活和迁移重要的信号蛋白的激活。在CLL中,Wnt5a/ROR1通过ARHGEF家族衔接蛋白激活Rho GTPase RhoA和Rac1,Wnt5a还诱导HS1的酪氨酸磷酸化,导致ROR1依赖的细胞迁移。此外,Wnt5a/ROR1诱导NF-κB信号通路的激活,导致促炎症细胞因子如IL-6的自分泌调节。因此ROR1的表达水平与CLL的进展密切相关,使其成为预后的良好生物标志物。
Takashi Takahashi博士领导的小组在一系列研究中调查了ROR1在肺腺癌中的作用,发现ROR1以激酶依赖性和激酶非依赖性方式支持促生存信号。ROR1的激酶活性被证明是调节HIF-1α表达、抑制ASK1-p38轴、氧化应激诱导的细胞死亡和C-SRC磷酸化所必需的。另一方面,ROR1可以以不依赖激酶的方式作为支架蛋白,促进Cavin-1/Caveolin-1相互作用并与Hsp90α结合。在Li等人的另一项研究中,ROR1被证明可磷酸化HER3,从而通过与Hippo-YAP途径交叉介导乳腺癌的骨转移。综上,在许多类型的恶性肿瘤中观察到ROR1的异常表达和相关的促生长信号事件,使ROR1成为抗癌药物开发的一个有吸引力的治疗靶点。
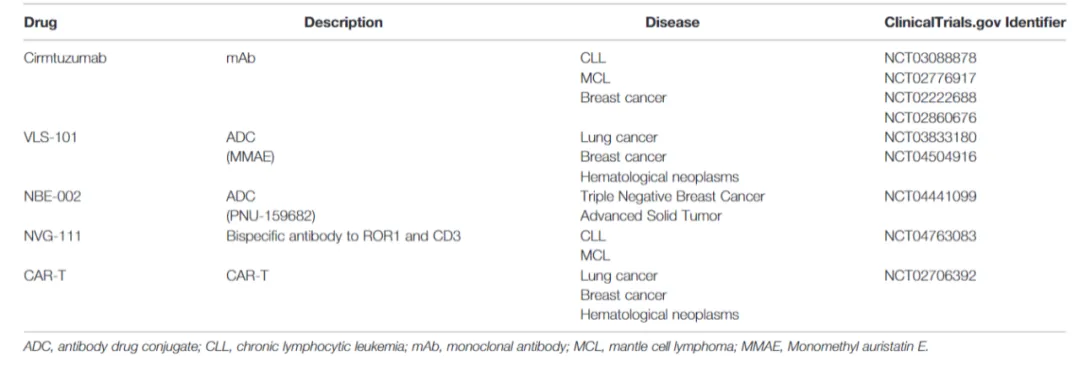
图2 临床试验中的靶向ROR1疗法
2020年,基石药业和Legochem Biosciences就其ROR1 ADC “ LCB71/ABL202 ”达成全球授权协议,基石药业将获得在韩国以外地区开发和商业化ROR1抗体偶联药物LCB71的独家授权。随后,默克收购了Velosbio及其ROR1 ADC “ VLS101 ”,勃林格殷格翰收购了NBE Therapeutics及其ROR1 IADC “ NBE-002 ”,收购成本(包括预付款和里程碑付款)分别为27.5亿美元和14.5亿美元。这些收购展现了ROR1在肿瘤学中的重要性及其作为ADC靶标的新兴作用。
3、ROR1靶向ADC举例
a、VSL-101
通过蛋白水解可切割接头MC-VC-PAB将mAb和微管蛋白聚合抑制剂MMA连接,利用ROR1靶向抗体UC-961,一种以高亲和力(Kd=2nM)与ROR1的域内表位结合的人源化抗体,并通过阻断Wnt5a与ROR1的结合而对各种ROR1阳性肿瘤细胞具有直接细胞毒活性。由于UC-961识别独特的表位,该抗体在结合时触发ROR1的明显内化,有利于向ROR1阳性肿瘤细胞特异性递送细胞毒性有效载荷。据2020年12月美国血液学会年会报道,PK 研究显示平均ADC半衰期约为2.5天,未检测到中和抗药物抗体(ADA)。该药物在全球的最高研发状态为临床2/3期,在中国的最高研发状态为临床2/3期。
b、NBE-002
目前,大多数经批准的ADC都是通过赖氨酸或半胱氨酸残基将有效载荷与单克隆抗体化学偶联而产生的药物异质混合物。而NBE-002是通过人源化抗体(HuXBR1-402)与蒽环类药物PNU-159682在预先确定的药物-抗体比率(DAR)下通过分选酶介导的位点特异性转肽反应进行酶结合而产生的,从而产生更纯、更同质的产物,具有更稳定的生物物理和药代动力学特征。HuXBR1-402衍生自通过噬菌体展示从幼稚兔抗体库中选择的嵌合兔/人mAb(XBR1-402)。XBR1-402以个位数的亲和力(Kd=5.8nM)与人ROR1的Ig/FZ 结构域中的表位结合,并且XBR1-402被人源化构建为ADC时没有丧失效力,同时保持相当的亲和力。该药物在全球的最高研发状态为临床2期,在中国暂未开展临床试验。
c、LCB71(CS5001)
LCB71由LegoChem Biosciences和ABL Bio两家韩国生物制药公司共同开发,基石药业获得了在韩国境外开发和商业化LCB71的专有权。LCB71使用了一种酶介导的位点特异性偶联技术,这种偶联方法利用farnesyltransferase,该酶天然催化CAAX基序中存在的半胱氨酸残基的异戊二烯基化(其中“ A ”代表任何脂肪族氨基酸,“ X ”代表决定特定异戊二烯基转移酶特异性的任何氨基酸)。LCB71 结合了特有的β-葡萄糖苷酸连接子和吡咯并苯二氮卓类(PBD)前毒素二聚体,连接子和前毒素均能被溶酶体β-葡萄糖醛酸酶切割,而β-葡萄糖醛酸酶在许多癌细胞中呈过度表达。这使其只有在到达肿瘤后,连接子被切割释放PBD前毒素杀死肿瘤细胞,有效地解决了与传统PBD载荷有关的典型毒性问题,拥有更好的安全性。该药物在全球的最高研发状态为临床1期,在中国的最高研发状态为临床1期。
4、ADC常见内吞途径
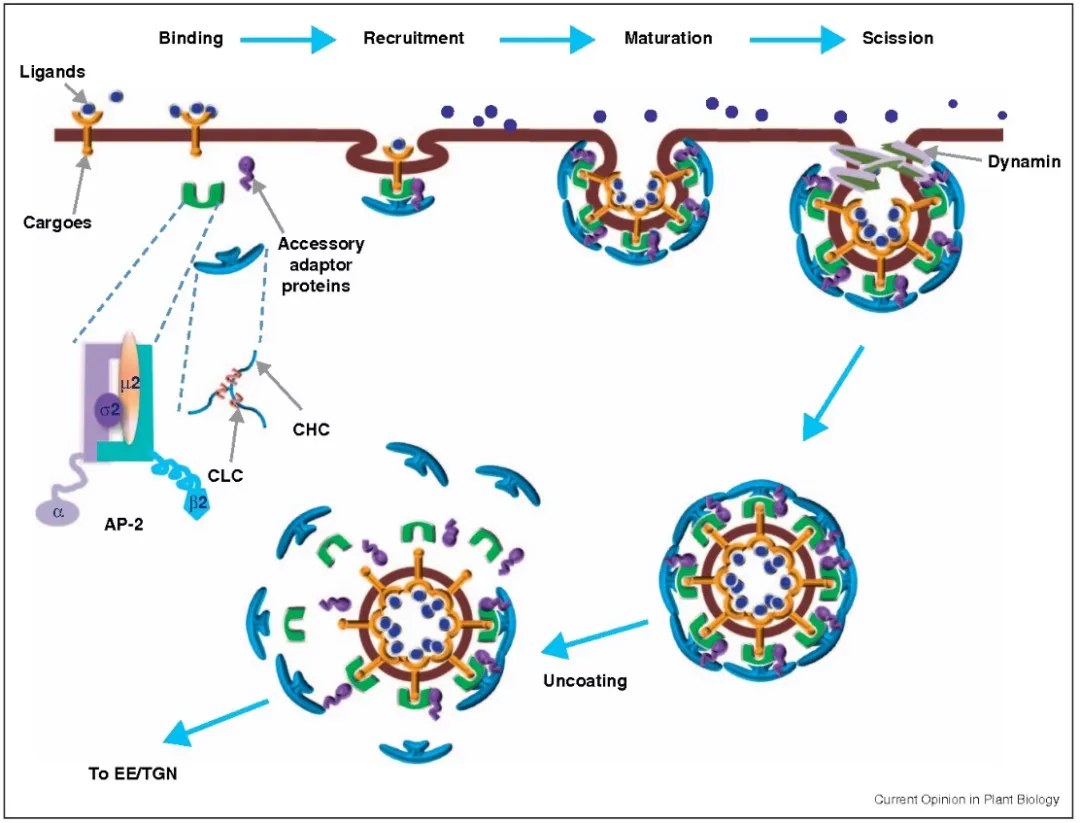
网格蛋白介导的内吞作用:网格蛋白介导的内吞作用(CME)包括几个连续和部分重叠的步骤。当细胞质中的内吞衣壳蛋白开始聚集在质膜的内小叶上时,CME启动。衣壳蛋白通过从细胞质中募集额外的蛋白质衔接子并与之相互作用而继续组装和生长,关键衔接蛋白能够使膜弯曲,从而将内化受体/配体集中到“网格蛋白包被的小坑”(CCP)中。通过CCP内陷增大,CCP颈缩窄,肌动蛋白聚合将CCP向内拉入细胞质,直到断裂完成,CCP释放并成为一个网格蛋白包被的囊泡(CCV)。最后,CCV外壳被分解,CCV与内涵体融合并被运输到特定的亚细胞位置,或者可以再循环回到细胞表面。网格蛋白是CME的关键成分,由重链和轻链组成。三个网格蛋白重链和轻链形成三聚体网格蛋白,与其他三聚体相互作用,并在新出现的CCP周围形成多边形晶格。
图3 网格蛋白介导的内吞作用
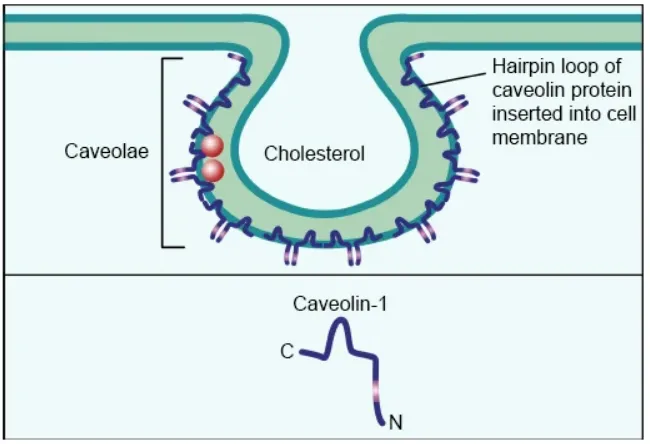
小窝介导的内吞作用:小窝是质膜的小瓶状内陷,其特征是高水平的胆固醇和鞘糖脂,通过不依赖于网格蛋白的途径介导内吞作用,在大多数细胞类型中都有发现。小窝的主要支架蛋白是小窝蛋白,它是20–24 kDa整合膜蛋白,形成寡聚多聚体。小窝蛋白共享共同的支架结构域,这些支架结构域介导与自身和其他包含小窝蛋白结合结构域的蛋白质的相互作用。通常,小窝蛋白-1在小窝内陷处形成14–16个单体的复合物,其磷酸化水平也有所增加,这是诱导小窝蛋白介导的内吞作用所必需的。尽管小窝具有类似CCPs的内陷形态,但它们是不同的,CCP的密度是恒定的,而小窝的密度会因细胞类型的不同而变化很大。CCPs随着萌发的内体成熟而增大,相比之下,小窝囊泡保持不变的大小。一旦进入细胞内,小窝就形成了高阶结构,而不是由CCPs形成的简单的球形内体。
小窝蛋白介导的内吞作用的另一个独特方面是,只有约1%的小窝是从质膜上萌发的。在一小部分内化的小窝中,它似乎遵循一条与Rab5(早期内胚体的标志物)共定位的循环途径。这可能对以利用小窝蛋白介导内吞作用的受体为靶点的ADC带来挑战。
图4 小窝蛋白介导的内吞作用
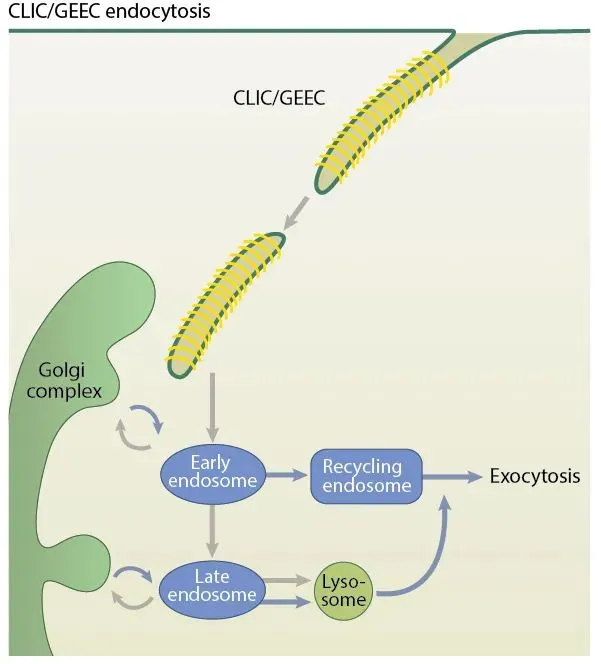
CLIC/GEEC内吞作用:小窝蛋白非依赖性载体蛋白/GPI-富集的早期内区室是一种内吞室,主要发生在配体激活的细胞中,可由生长因子、抗体的受体交联或细菌毒素和病毒引起。此外,细胞膜必须处于高流动性状态,因为CLIC/GEEC在低于生理温度或膜处于更高张力的情况下不起作用。识别CLIC/GEEC途径的其他相关参数包括动力非依赖性质膜断裂、对胆固醇消耗的敏感性、Rab5/与早期内体融合的获得、胎盘碱性磷酸酶(PLAP)和与FAK相关的GTPase调节因子(GRAF1)。
图5 CLIC/GEEC内吞作用
巨胞饮作用:一种更大规模的内吞作用形式,通常涉及质膜高度皱褶的区域/突起,随后相互融合或与质膜融合。膜皱褶是巨胞饮作用的形态学特征,这一过程导致细胞外液的摄取和这些位点内捕获的成分。巨胞饮作用依赖于肌动蛋白聚合、Rac1蛋白和p21活化激酶1(PAK1)。PAK1是一个关键的调节因子,因为它与Rac1相互作用从而激活磷脂酰肌醇-3-激酶(PI3K)、Ras、SRC和Hsp90,以促进巨胞饮作用。巨胞饮作用也是胆固醇依赖性的,这是募集Rac1所必需的。这些成分最终导致比CME和小窝蛋白更大膜面积的摄取的过程。
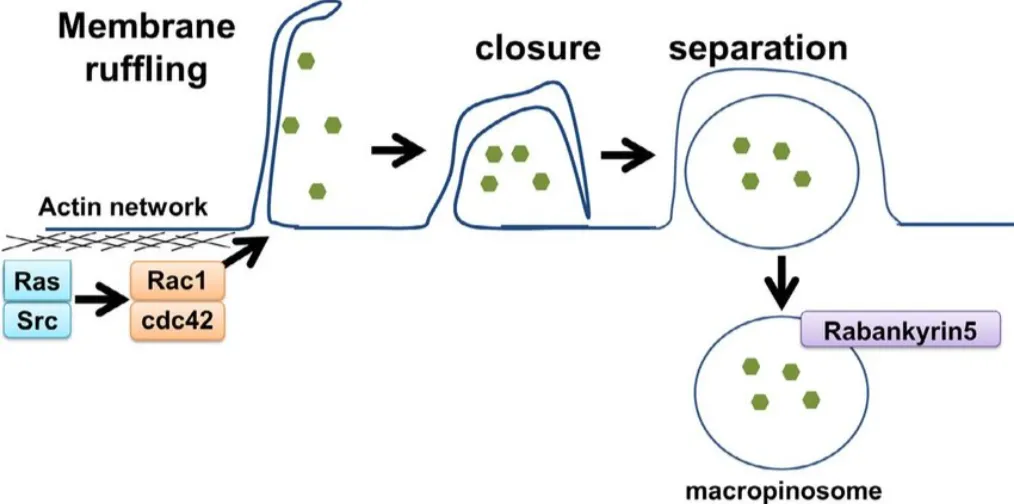
图6 巨胞饮作用

图7 ADC药物的内吞机制
参考文献
1. Tyrosine Kinase ROR1 as a Target for Anti-Cancer Therapies. Front Oncol. 2021 May 28;11:680834. doi: 10.3389/fonc.2021.680834.
2. Perspectives on the development of antibody-drug conjugates targeting ROR1 for hematological and solid cancers. Antib Ther. 2021 Oct 15;4(4):222-227. doi: 10.1093/abt/tbab023.
3. Impact of Endocytosis Mechanisms for the Receptors Targeted by the Currently Approved Antibody-Drug Conjugates (ADCs)-A Necessity for Future ADC Research and Development. Pharmaceuticals (Basel). 2021 Jul 15;14(7):674. doi: 10.3390/ph14070674.