rAAV载体的包装
AAV的包装需要细胞致病作用,这种作用只有在与辅助腺病毒或疱疹病毒共同感染后才会发生。目前在HEK293细胞中包装rAAV载体不推介使用辅助病毒,而是使用质粒pHelper代替,它含有E2A、E4和VA RNA基因。但要通过生产细胞系包装rAAV,就离不开辅助病毒的使用。rAAV的包装最常用的是三质粒共转染HEK293细胞,但为了降低大量GMP级别的质粒使用,有研究在探索通过稳转得到生产细胞系来生产rAAV。下面介绍经典的三质粒瞬时共转染HEK293细胞包装rAAV的方法
[1][2][3]和稳转HEK293筛选得到单克隆生产细胞系生产rAAV方法
[4][5]。
一、三质粒瞬转法
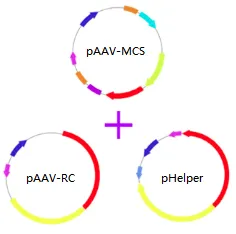
三质粒瞬转法需3个质粒:1个重组表达质粒和2个辅助质粒。pAAV-MCS转移质粒:包含ITR序列,CMV启动子,目的基因等;pHelper辅助质粒: 包含腺病毒的VA、E2A和E4基因,辅助rAAV的包装;pAAV-RC质粒:包含Rep和Cap基因,决定rAAV的血清型和组织嗜性。构建AAV表达载体质粒,AAV表达载体包括了两个ITR + CMV(可替换其他组织特异性启动子)+目的基因+ poly A序列等。最后将表达载体质粒、辅助质粒和包装质粒共转染表达有腺病毒E1基因HEK293细胞,在细胞中进行rAAV的包装。
图6 三质粒
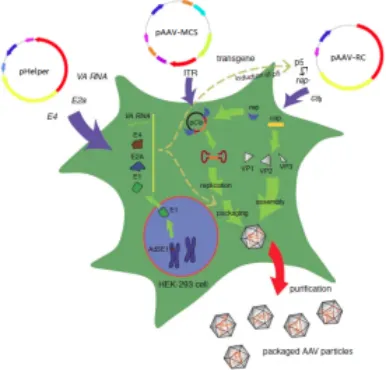
图7 三质粒共转
HEK293细胞培养
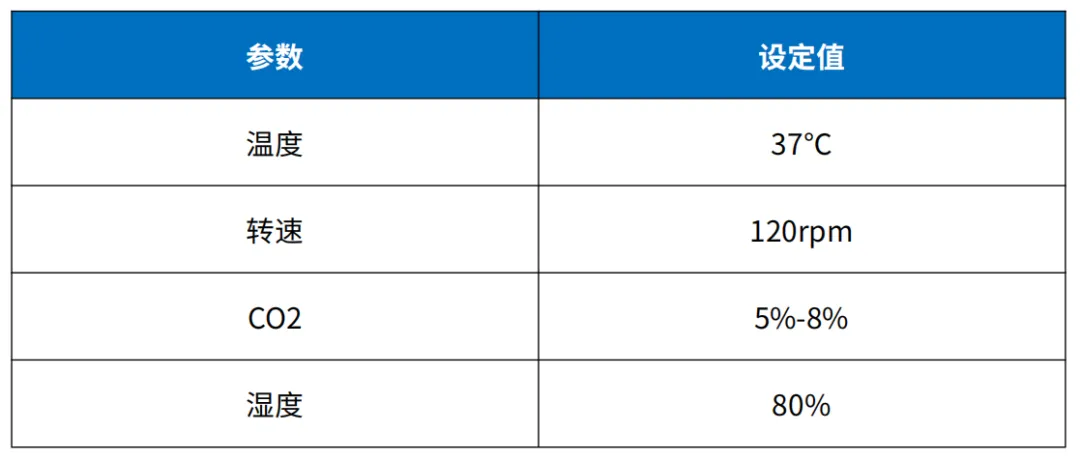
复苏HEK293细胞到生长培养基或直接到病毒生产培养基中放入二氧化碳培养箱培养,2-3天进行传代,最好传代次数在3-10代用于转染,最多不要超过30代。
表1 细胞培养参数
三质粒共转染
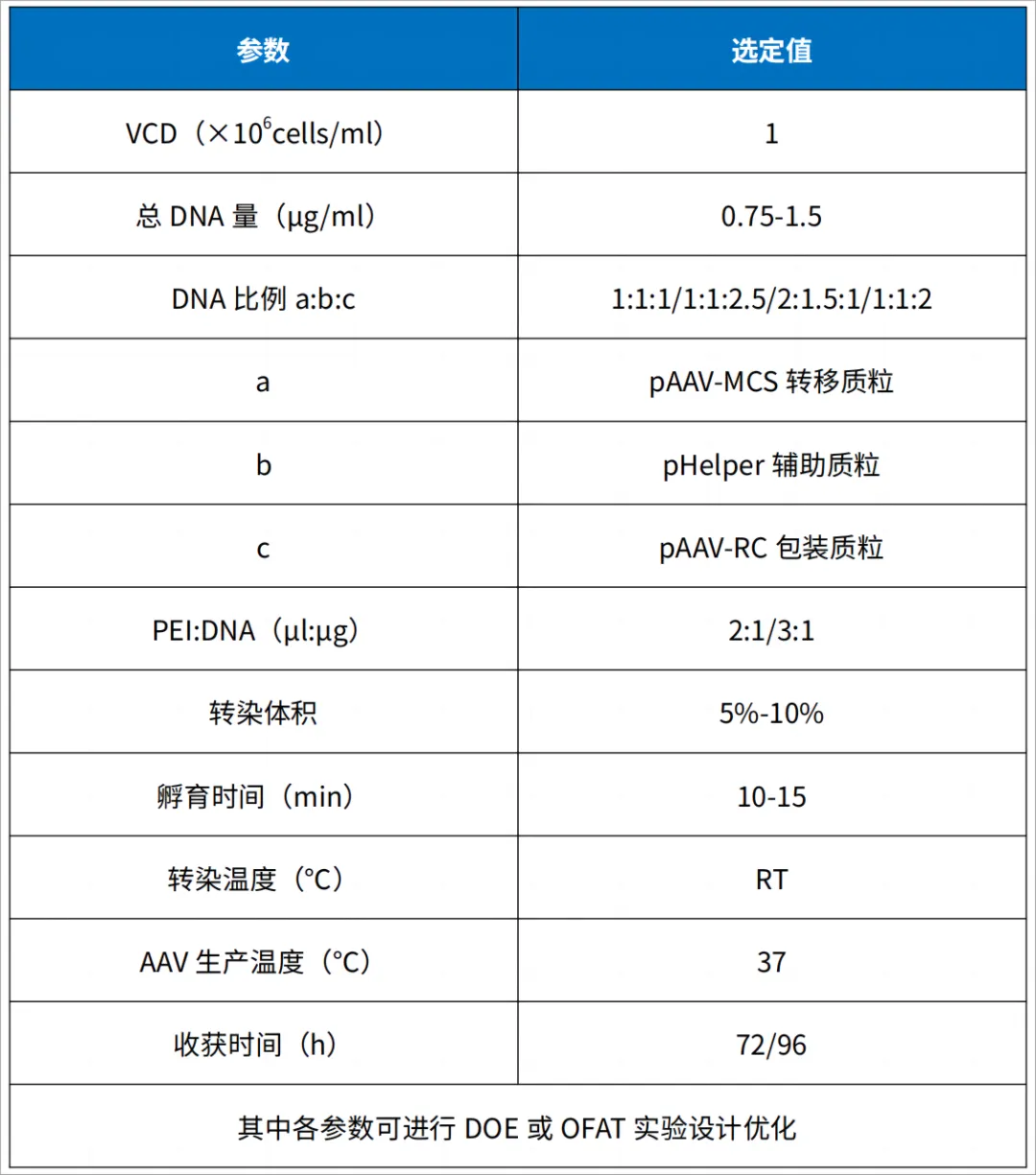
A. 转染当天计数,待细胞长至3-4×106cells/ml,活率>90%时,用新鲜培养基稀释至1×106cells/ml,继续培养待用。
B. 每1×106细胞使用质粒总量为0.75-1.5μg,PEI:DNA为2:1或3:1。
C. 用适量新鲜培养基分别稀释DNA和PEI,温和混匀后室温孵育5-10min。
D. 将稀释的PEI加入到DNA中,温和混匀后室温孵育10min,总孵育体积在5%-10%。
E. 转染时,将DNA-PEI复合物稀释液加入细胞培养液,轻轻摇匀并放入培养箱继续培养。
F. 培养72h/96h收获细胞,检测滴度。
表2 转染参数
二、Gateway™ pENTR™ 11 双重选择载体构建生产细胞系
为了消除瞬时转染步骤,避免使用野生型辅助腺病毒,需要在HEK293细胞的基础上建立AAV生产细胞系。但产生基于HEK293细胞的rAAV生产细胞系的主要困难是E1介导的AAV启动子p5和p19的激活,这两个启动子控制AAV Rep蛋白,被认为具有细胞抑制作用,甚至具有细胞毒性。有报道开发了一种新的基因表达控制系统,称为双切片开关系统,是将一个内含子和三个聚腺苷化元件插入到Rep基因编码区,破坏所有Rep转录本,再通过Ad-Cre诱导AAV Rep基因在rAAV生产细胞系中重建并激活Rep基因的表达。通过使用这种控制开关系统,成功地获得了基于HEK293的高稳定性和高载体产量的rAAV包装细胞系。下面来介绍该方法
[7]:
载体构建
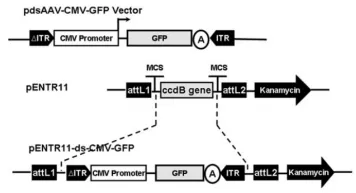
单链/双链AAV载体:将从单链/双链质粒中酶切得到ITRs和CMV-GFP片段插入到pENTR11质粒中,得到质粒pENTR11-ss-CMV-GFP和pENTR11 -ds- CMV-GFP。
图8 pENTR11 -ds- CMV-GFP质粒
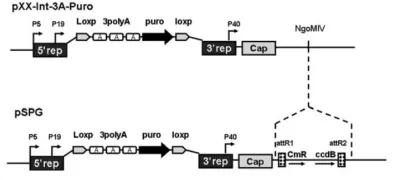
将pXX2-Int-3A-Puro作为Rep/Cap基因的包装构建体。在该质粒非编码区NgoMIV的单限制性内切位点插入重组位点和氯霉素耐药性基因(CmR)。按照制造商说明,将含有ccdB基因、attR1和attR2位点的Gateway转换组件插入pXX2-Int-3A-Puro的NgoMIV位点,将连接产物转化为耐受ccdB基因的特殊大肠杆菌菌株,在含有30 mg/ml氯霉素和50 mg/ml氨苄青霉素的LB板上选择重组克隆,获得AAV2目的质粒pSPG2。
图9 pSPG2质粒
为了构建AAV特异性血清型和载体细胞系的诱导包装质粒,将含有ITR的载体质粒通过attL-attR(LR)重组反应有效地重组到特定血清型pSPG2质粒中。将pENTR11-ds-CMV-GFP与pSPG2重组,将重组产物转化到DH10B感受态细胞中,并将其涂于含有100 mg/ml氨苄青霉素的LB琼脂板上。由于重组后,将ccdB基因从目的载体上去除,重组后的可诱导包装质粒在DH10B中生长,得到pSPG2- ds-CMV-GFP诱导质粒。
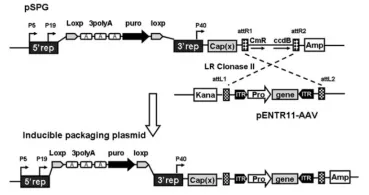
图10 pSPG2- ds-CMV-GFP质粒
质粒转染获单克隆细胞系及rAAV生产
转染步骤
A. pSPG诱导质粒(3μg)经AseI酶切,DNA沉淀线性化。
B. 线性化质粒溶解于10 ~20μl TE(pH7.0),加入到含有0.25 M CaCl2离心管中,然后快速与125μl 2X HEPES缓冲盐混合,加入到六孔板的HEK293细胞中。
C. 转染后12小时,转移至含有培养基2 μg/ml嘌呤霉素的新鲜培养基中。
D. 48小时后,将转染的细胞连续稀释,最后挑选出单克隆细胞。
E. 用在CMV启动子驱动下携带P1噬菌体Cre重组酶基因的腺病毒载体Ad-Cre以MOI为5感染单克隆生产细胞系。
F. 感染48h后收集细胞和上清,进行3次冻融循环以释放细胞中的rAAV,然后在56℃水培养箱中培养1h,使辅助Ad-Cre病毒失活。
此方法可以选择悬浮的HEK293细胞转染进行单克隆筛选,易于产能的放大。辅助病毒的应用会导致最后很难被清除,同时腺病毒的存在会增加下游纯化的压力,并可能引起不希望的影响,如宿主的炎症。所以需要进一步探索其他方法来构建稳转生产细胞系。
三、Atum转座子构建生产细胞系
上述两种方法生产rAAV依赖于生产细胞的质粒转染或腺病毒感染,这在工艺规模上构成了一定挑战。下面介绍一种利用合成生物学方法构建了一种无转染、无辅助病毒的rAAV生产细胞系。该方法利用Leap-In转座子将AAV包装的基因转到HEK293细胞中克隆得到稳转生产细胞系
[8]。
各模块的构建
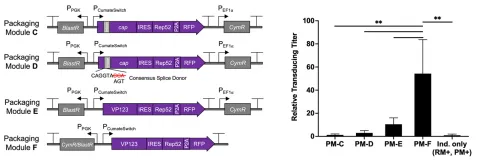
rAAV基因组模块(GM):将rAAV2-GFP基因组克隆到由磷酸甘油激酶启动子驱动的嘌呤霉素抗性基因的Leap-In转座子骨架中获得。复制模块(RM):利用集成DNA技术合成Rep68序列,用荧光探针和突变体FKBP12不稳定结构域标记Rep68,然后被克隆到TetON启动子的下游。将通过PCR从pHelper质粒中扩增出腺病毒E4orf6和DBP序列,再通过一个P2A链接器连接,生成的CDS克隆到GeneSwitch启动子下。将Rep68、辅助转录单元以及GeneSwitch反转录因子基因克隆到一个Leap-In转座子骨架中。包装模块(PM):将从pAAV-RC2进行 PCR扩增得到的AAV Cap CDS通过ECMV IRES与AAV Rep52连接,置于CumateSwitch开关启动子下,将转录单元克隆到含有杀稻瘟菌素抗性基因和Cym阻遏子的Leap-In转座子骨架中。
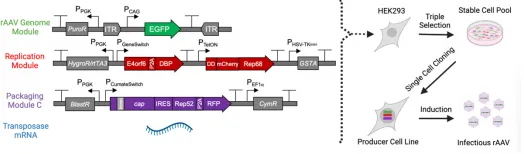
图11 转座子模块
PM的元件优化,通过调整不同的PM中的各调控元件,构建不同的包装模块,进行共转染,瞬转表达rAAV,发现PM-F模块的病毒滴度要远高于其他包装模块。最后选择PM-F来作为最终的包装模块。
图12 优化后PM模块
转座子整合到HEK293获生产细胞系及生产rAAV
A. GM、RM、PM-F与Leap-In转座酶mRNA以DNA:RNA为1:1共转染HEK293细胞。
B. 培养3天后,将细胞传代至含有2 μg/mL嘌呤霉素、200 μg/mL潮霉素B 和10μg/mL 杀稻瘟菌素的培养基中。
C. 筛选2周后,通过极限稀释,在96孔中进行单克隆细胞筛选。此方法筛选的单克隆细胞有生产细胞系和包装细胞系。其中包装细胞系是GM模块没有转入所得到。
D. 将单克隆细胞接种后,加入诱导物5μg/mL多西环素、10 nM米非司酮和30 μg/mL 4-异丙基苯甲酸。
E. 对于包装细胞,接种后1天,细胞用GM模块瞬时转染,4天后收获细胞。
F. 在接种诱导4天后收获细胞。
利用该方法得到的生产细胞系需要诱导剂诱导产生rAAV,且所生产的rAAV的滴度不是很理想,比三质粒共转表达水平要低2个数量级,但是却得到较高的完整颗粒病毒。通过Atum转座平台,实现了包括目的基因,复制元件和包装元件的表达控制,让稳转细胞株有更好的操控性,也更适合生产放大,无辅助病毒的存在,也降低了下游纯化压力,但产量还需要进一步的去优化设计。
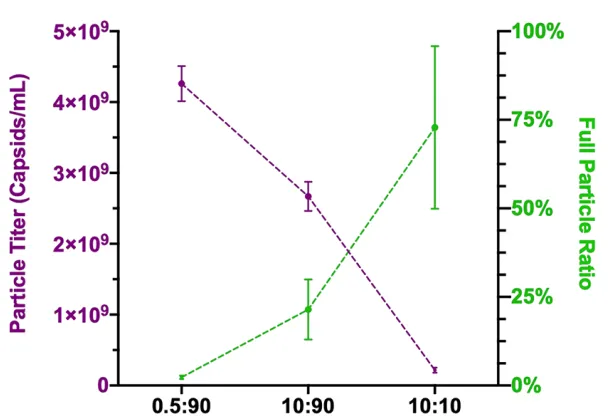
图13 生产细胞系产率
四、小分子物质能否提高rAAV包装?
许多小分子增强剂已经在多种重组蛋白生产哺乳动物细胞系中证明了有效性,然而在rAAV的包装中也是否有效呢?一些研究表明了其中一些小分子物质也能提高rAAV的滴度,例如Nocodazole(抗有丝分裂剂)和M344(选择性组蛋白去乙酰化酶抑制剂)在转染24h添加后rAAV的滴度分别增加1.34倍和1.36倍。在转染4小时后添加4µM Nocodazole可使得rAAV滴度增加2.5倍或者是添加4µM Nocodazole和2.5µM M344的组合物使得rAAV滴度增加2.6倍[6]。在转染18h后加入5mM丁酸钠和0.5%的蛋白水解物TN1增加了衣壳蛋白的表达
[1]。
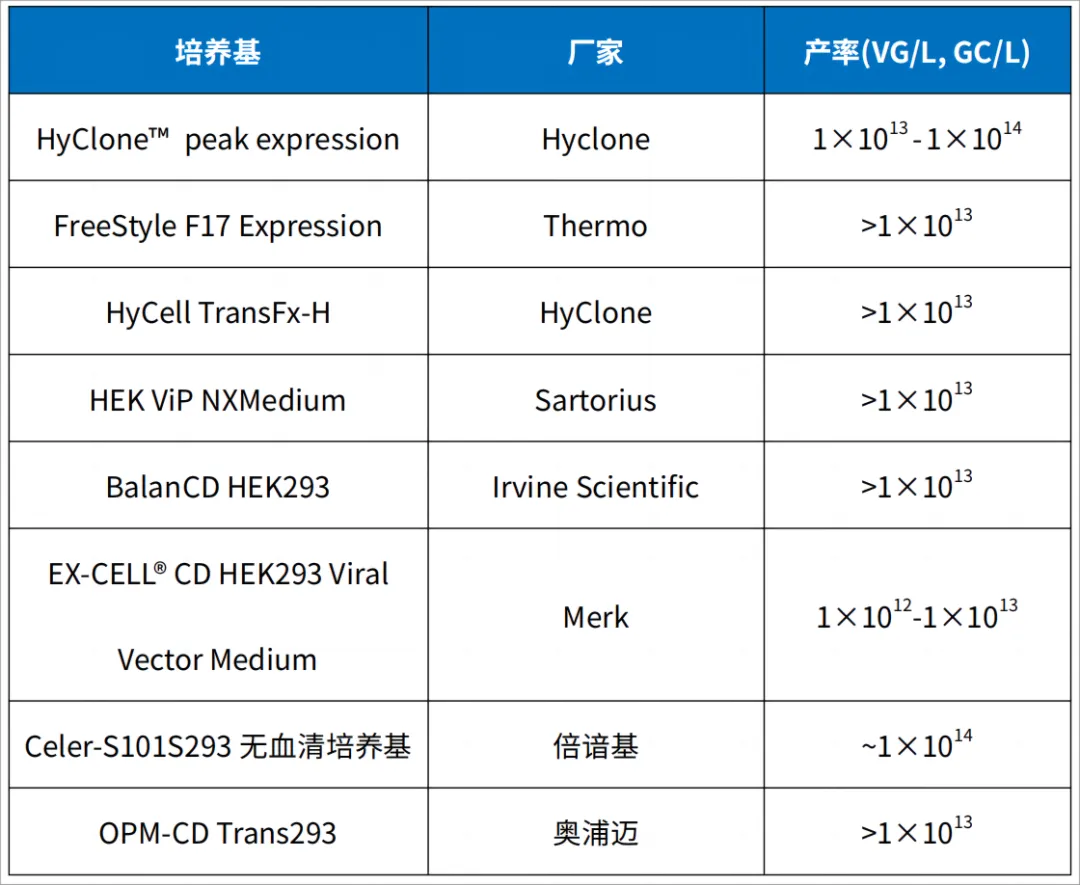
五、国产和进口培养基包装rAAV产率比较
市面上有多种培养基可用于rAAV生产,且产率各不相同,下面对各培养基生产rAAV产率进行一个统计,且各产率都是经过工艺优化所得。这些培养基对不同的293细胞类型所得的产率不同,这需要大家根据自己的293细胞类型对不同的培养基进行筛选。以下信息供参考。
表3 不同培养基rAAV产率比较
六、当前生产rAAV的方法
rAAV的生产不仅限于在HEK293细胞中包装。当前生产临床使用的rAAV的平台有多种,其中包括瞬时转染平台、哺乳动物细胞生产平台、昆虫细胞生产平台,他们之间各有优缺点,参考下图。
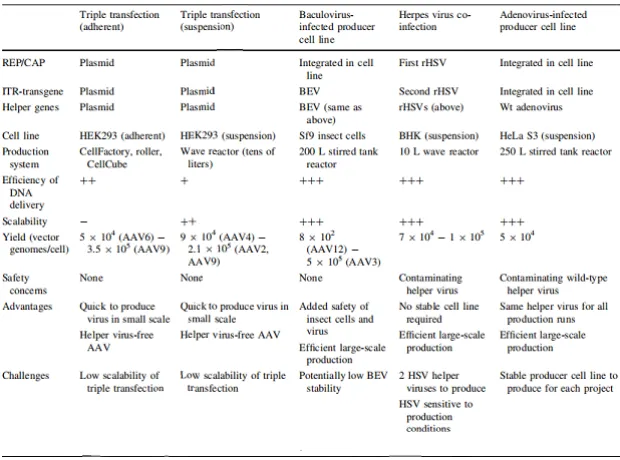
图14 临床用rAAV生产方式
七、结语
上述介绍了在HEK293细胞中生产rAAV的瞬转和稳转方法,其中三质粒瞬时共转是当下很多企业选择的生产方式,而稳转的方法还是不够成熟和稳定。但由于当前GMP级别的质粒生产和rAAV产能的限制以及高生产成本的投入,迫切急需探索出创新性的稳转生产细胞系以满足日益增长的市场需求,降低生产成本,为患者减轻医疗负担。
参考文献
[1] Creation of a high-yield AAV vector production platform in suspension cells using a design-of-experiment approach[J]. Molecular Therapy-Methods & Clinical Development, 2020, 18: 312-320.
[2] Production of recombinant adeno-associated virus vectors using suspension HEK293 cells and continuous harvest of vector from the culture media for GMP FIX and FLT1 clinical vector[J]. Molecular Therapy, 2016, 24(2): 287-297.
[3] Production of adeno-associated virus (AAV) serotypes by transient transfection of HEK293 cell suspension cultures for gene delivery[J]. Journal of virological methods, 2014, 196: 163-173.
[4] A versatile adeno-associated virus vector producer cell line method for scalable vector production of different serotypes.Hum Gene Ther. 2011 May;22(5):613-24.
[5] Construction of an rAAV producer cell line through synthetic biology[J]. ACS Synthetic Biology, 2022, 11(10): 3285-3295.
[6] Increased recombinant adeno‐associated virus production by HEK293 cells using small molecule chemical additives[J].Biotechnology Journal, 2023, 18(3): 2200450.
[7] Construction of an rAAV producer cell line through synthetic biology[J]. ACS Synthetic Biology, 2022, 11(10): 3285-3295.