1. AAV简介及基因组组成
1965年,腺相关病毒(AAV)从实验室腺病毒(AdV)制剂中发现的,并且很快就在人体组织中发现
[1]。AAV是微小病毒科(parvoviridae)家族的成员之一,是一类无法自主复制、无被膜的二十面体微小病毒,其直径约20-26nm,含有4.7kb左右的线状单链DNA作为基因组。灵长类动物体内有13种不同血清型:AAV1 -AAV13,其中AAV2、AAV3、AAV9源自人类本身,AAV2是最早被克隆的病毒,也是迄今研究最为彻底、应用最为广泛的病毒载体。
图1 AAV发现
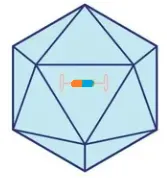
AAV 基因组主要由反向重复序列(ITRs)和2个ITR之间的2个开放阅读框(ORF)组成,左侧ORF编码Rep78、Rep68、Rep52和Rep40等四种Rep蛋白参与病毒基因的复制[2],右侧ORF中Cap基因编码3种组成病毒衣壳蛋白VP1、VP2、VP3,以1:1:10的比例组装到总共60个单体[3],每个亚基在病毒粒子表面有9个可变区域,这些区域决定了AAV载体的主要倾向和细胞内运输,并且通常是中和抗体识别的区域。嵌入部分编码装配激活蛋白(AAP),膜相关辅助蛋白(MAAP)。
ITR是多用途元件,作为病毒基因组封装的包装信号,以及病毒基因组复制的起始位点。以上9个辅助和结构蛋白基因的表达受三个不同的启动子p5、p19和p40的调控。p5驱动辅助蛋白Rep78和Rep68的表达,而p19则是控制Rep52和Rep40,p40调节VP1、VP2、VP3、MAAP和组装AAP的表达,AAP是最近发现的一种蛋白,在大多数血清型中促进衣壳组装起关键作用[2]。虽然AAP在AAV2中对VP蛋白的核定位和衣壳组装至关重要,但AAP在其他不同的血清型中的亚核定位存在差异,并且在AAV4、AAV5和AAV11中不是必需的。
图2 二十面体示意图
图3 AAV基因组
2. 重组AAV载体及进入宿主细胞机制
AAV载体是治疗多种人类疾病的基因传递的主要平台。最近在开发临床所需的AAV衣壳,优化基因组设计和利用革命性的生物技术方面的进展大大促进了基因治疗领域的发展。目前,AAV由于其低免疫原性、限制中和抗体的产生和复制缺陷而成为基因治疗的理想选择。
重组AAV(rAAV)载体通常是将野生型 AAV(Wt-AAV)中的Rep和Cap基因用目的基因所取代,只保留AAV基因组两端的2个ITRs,本质上是一种基于蛋白质的纳米颗粒。它被设计成穿过细胞膜,可以在细胞膜上运输和传递它携带的目的基因装载到细胞核中。rAAV不含任何病毒基因,因此不会有活跃的病毒基因表达来放大免疫反应。rAAV无宿主基因组整合风险,随着时间的推移,随着细胞的反复复制,最终会被稀释,这将最终导致转基因和转基因表达的丢失。转导后rAAV基因组以游离体的形式存在于细胞中,有助于转基因在细胞中的长期表达,rAAV在细胞分裂不旺盛的组织中可持续表达6个月以上。因此,rAAV载体被视为“明星载体”,也是最有前途的基因研究和基因治疗载体之一。
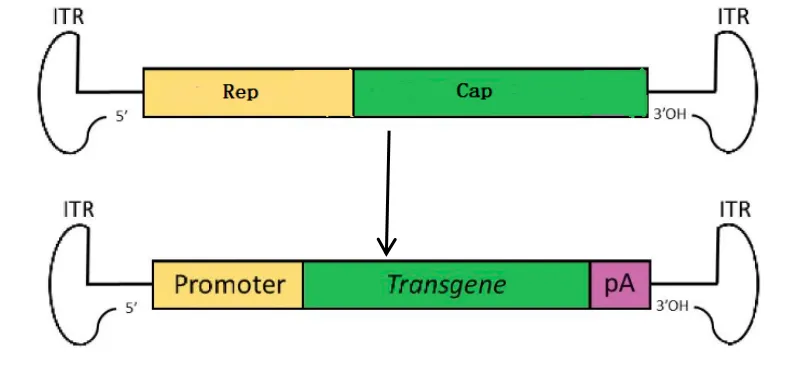
图4 rAAV基因组成
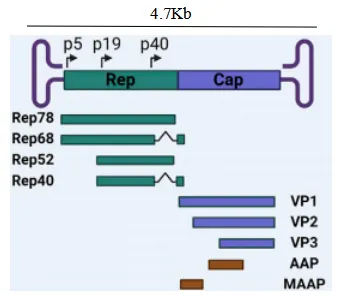
rAAV颗粒通过与宿主细胞表面表达的糖化受体相结合
[4],通过网格蛋白(Clathrin)介导的内吞作用进入细胞。内吞形成的内体(Endosome)并转移到溶酶体(Lysosomal)内[5],晚期在低pH促进衣壳的形态变化,导致衣壳表面磷脂酶A2基序暴露,导致病毒逃逸到细胞基质中[6],并且通过VP1独特区域编码的核定位信号以及与核孔复合物的相互作用介导从核孔进入细胞核
[5]。进入细胞核后,单链DNA从衣壳中释放出来,以游离体形式存在。单链DNA可以利用宿主细胞的DNA聚合酶来合成互补链,或者两条从不同AAV颗粒中释放的互补链自互补形成双链DNA,之后进行转录
[1]。
图5 rAAV作用机制
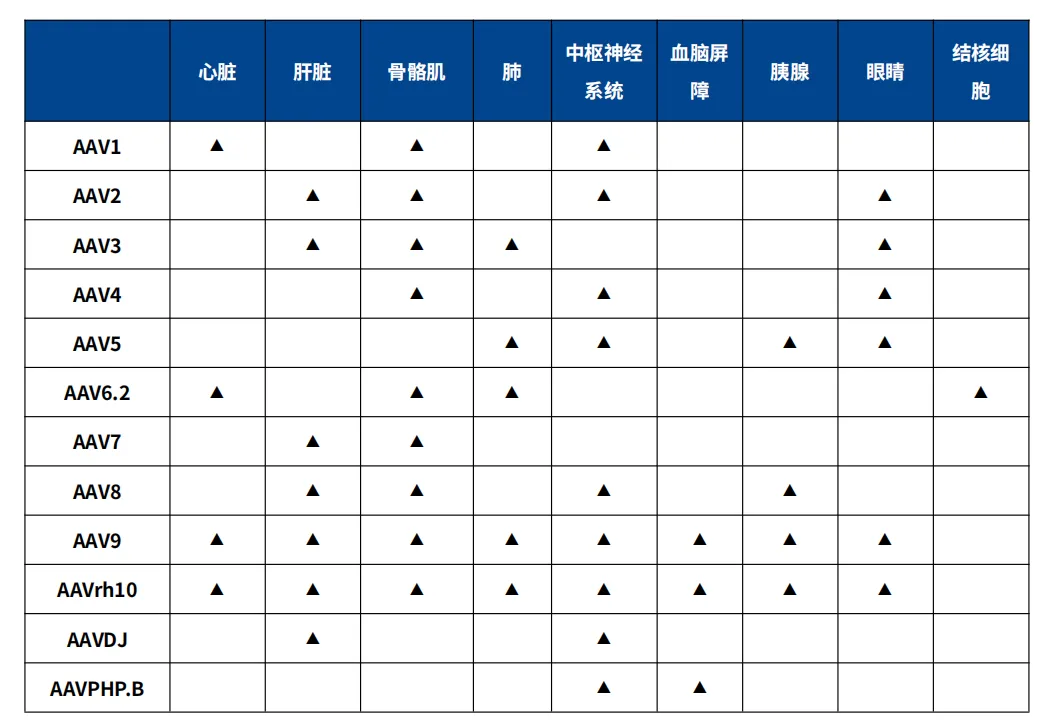
3. 不同血清型rAAV对应的组织嗜性
rAAV作为基因治疗载体,需要进行合适的衣壳蛋白选择来靶向不同的靶组织。这其中就涉及到对组织的感染嗜性,不同血清型rAAV对组织的感染嗜性不同,是由于其衣壳蛋白的差异所导致,衣壳序列的差异所编码的糖结合偏好的细微差异可以影响AAV对各种细胞类型的转导偏好。rAAV由于其衣壳蛋白VP3的核心由保守的β-桶基序组成,决定了不同血清型AAV与宿主细胞作用受体的差异,导致对不同组织的嗜性不同[7]。下面列出了一些rAAV对应的组织嗜性。
表1 不同血清型rAAV的组织感染嗜性
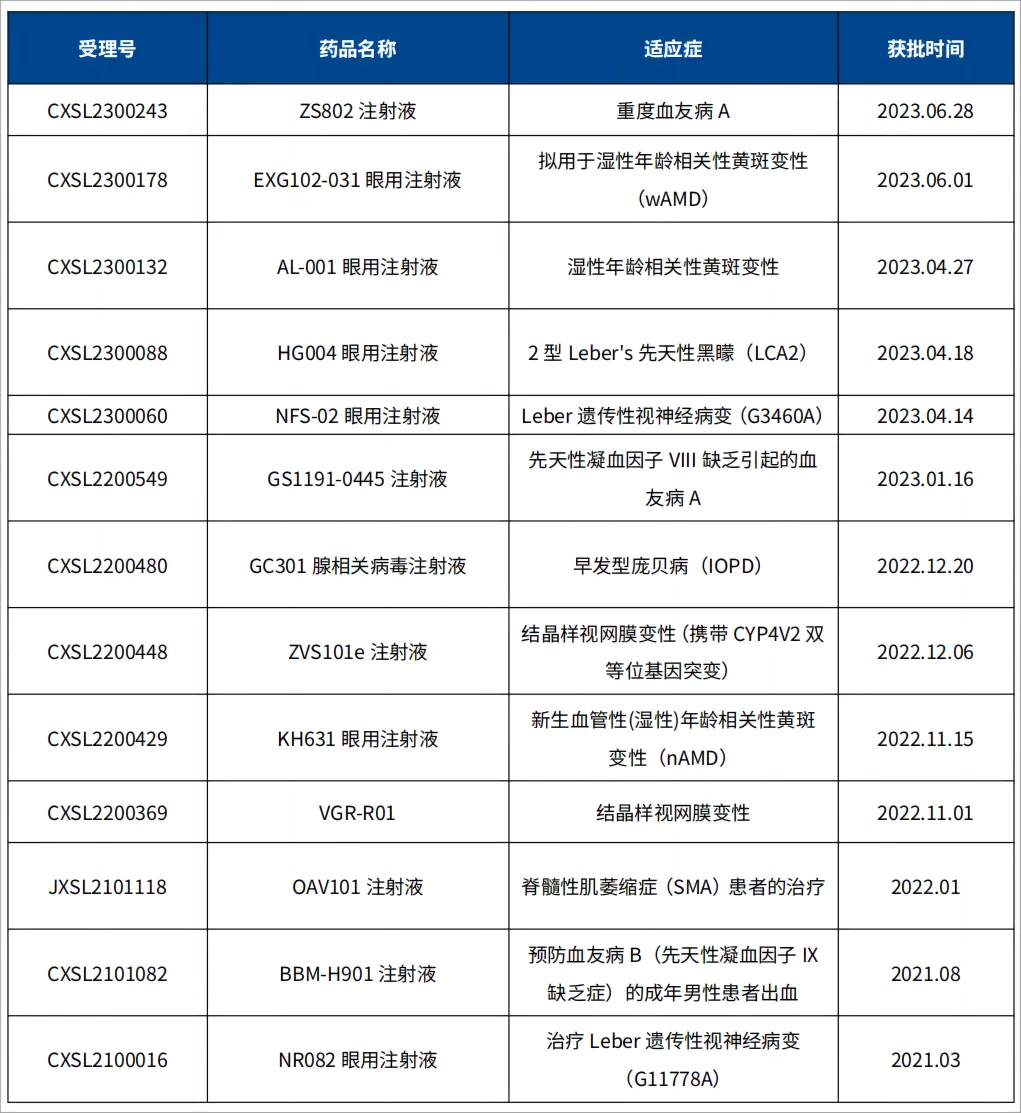
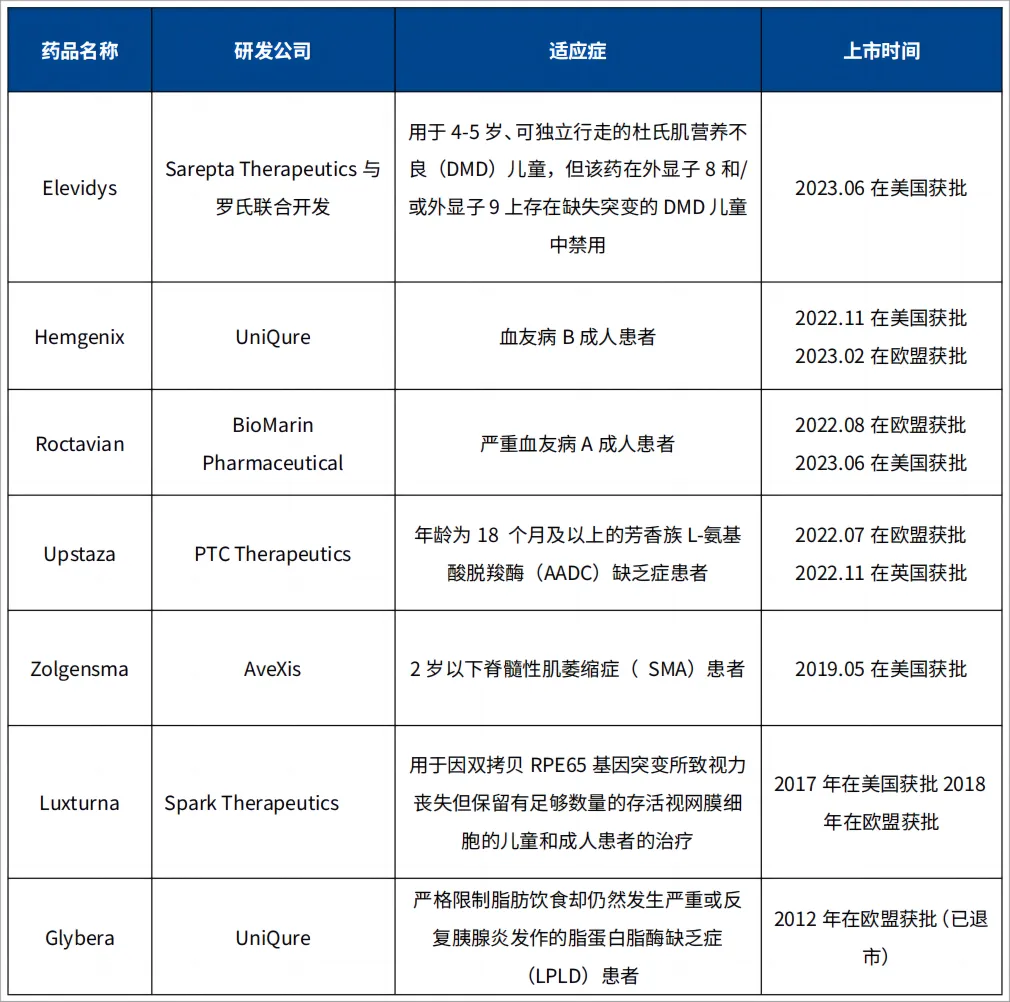
4. 国内rAAV基因治疗临床申报和全球已上市产品
随着越来越多的rAAV载体过渡到后期临床试验和营销阶段,与制造过程相关的其他问题也出现了。主要障碍之一是满足GMP生产的rAAV日益增长的需求的能力有限。尽管如此,目前国内已有二十几款rAAV基因治疗药物IND申报获批,其中3款进入Ⅲ期临床,其中大部分都是针对眼部疾病的开发。目前全球已有多款基于rAAV基因治疗产品上市,2012年首个基于AAV基因递送方法的基因治疗产品Glybera在欧洲被批准用于脂蛋白脂肪酶缺乏症患者,但在2017年已退市。2017年首个FDA批准的AAV基因治疗产品Luxturna用于RPE65基因突变所致视力丧失。以下是部分相关信息汇总。
表2 国内rAAV基因治疗获CDE批准统计
表3 全球已上市 rAAV 基因治疗产品
5. 结语
40多年来,将基因和其他核酸转移到细胞中一直是实验室的一种研究工具。当前小分子和蛋白质治疗平台的局限性推动了寻找适应这些局限性的替代治疗平台。基因疗法适应了这些所有限制,特别是在目标可及性方面。因此,寻找安全有效的基因传递技术一直是药物研究和开发的主要焦点。
AAV由于其独特的生物学特性、简单的结构和无已知的相关性疾病,AAV可能成为大多数基因治疗应用的载体选择。使用rAAV的基因治疗已被证明是安全的,并且在几乎所有使用它的临床环境中都具有良好的耐受性。这些研究,以及对其生物学的基础研究,揭示了这种载体的许多方面,可以应用于未来的基因治疗。同时,rAAV需要考虑的关键参数包括载体设计、衣壳选择、所需的靶细胞和组织类型以及给药途径。传递基因的表达优化,正确的AAV变体与适当的衣壳靶细胞转导和免疫反应性,以及适当的递送方法,以最大限度地提高靶组织暴露,同时限制非靶组织暴露是AAV作为基因治疗的关键焦点。