生物药在临床给药前的操作过程,以及所接触到的成分都会影响到药品的稳定性。因此,药品生产企业必须规范药品临床的处理过程,以确保患者使用药品的质量。ICH Q8指出,“应解决药品与配伍稀释剂相容性的问题。”
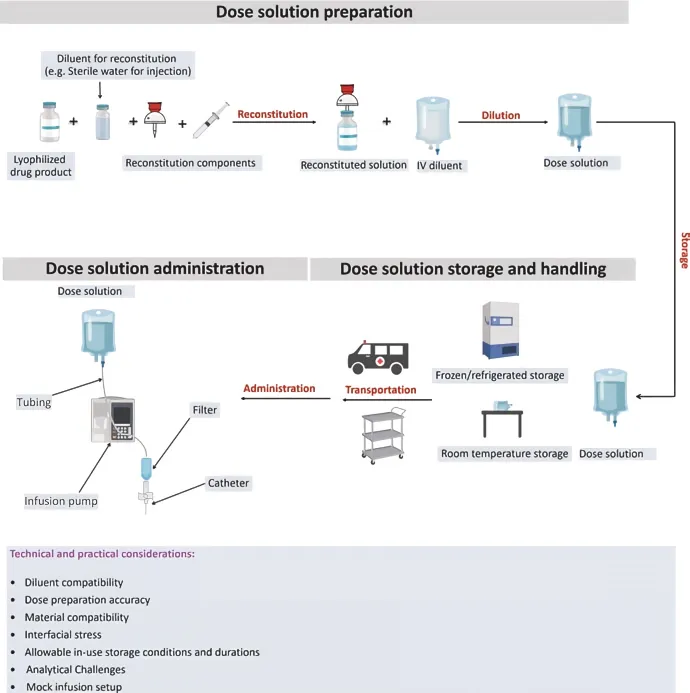
制剂临床配伍相容性研究(Clinical in use stability study,CIU)目的就是在实验室评估临床配伍过程对药物物理化学或微生物属性的影响,通常包括与稀释剂的相容性、剂量准确性、与给药装置的相容性、模拟输液及配伍后溶液储存条件和有效期等。企业需将此信息作为申报资料一部分提交。图1以冻干产品的静脉给药为例,展示了临床配药中产品可能经历的一些过程。每一步骤都可能会影响到产品的质量/给药剂量。
图1 典型的临床药品配制、处理和给药过程(以冻干IV产品为例)
一、稀释剂相容性
临床上最常用的等渗静脉稀释液为0.9%氯化钠注射液(生理盐水)、5%葡萄糖注射液(D5W)和乳酸林格氏注射液,稀释步骤改变了产品的关键配方因素,如pH值、离子强度和辅料浓度,这些都可能会影响蛋白质的稳定性。因此,在研究中必须评估稀释剂对蛋白质的影响。
通常建议筛查并启用多种稀释剂,及覆盖最差条件下的使用场景。如测试符合临床剂量范围的最低和最高剂量溶液浓度的稳定性,并在适用的储存温度下评估最差条件下的储存时间。
例如,如果I期研究的预期临床剂量范围在0.1 mg/kg和1.0 mg/kg之间,患者体重范围为40-120kg,所需的剂量在4 mg和120 mg之间。如果计划用50 mL的输液袋进行临床给药,输液袋中的标准溶液浓度范围将在0.08 mg/mL至2.4 mg/ mL之间。不同生产商的输液袋装量差异很大,因此,可以选择约0.06-2.75 mg/mL(目标± 15%)的范围,以确保稳定性。此外,为了避免输液袋等给药组件的相互作用,建议本阶段在惰性玻璃容器中制备成品作为研究对照。
二、剂量准确性
不同医院在药品复溶、溶液抽取和转移时使用的制备方法差别很大,这可能会影响配制的准确性。在操作过程中,通常使用一次性注射器、输液袋、旋塞装置和封闭系统转移装置(CSTDs)进行上述操作。最终所使用组件的死体积可能会影响剂量制备的准确性。例如,配制溶液过程中使用的注射器的大小和刻度会导致溶液浓度的变化。
在配方开发过程中,应尽早评估使用中的需求。例如,如果I期研究的预期临床剂量范围在0.1 mg/kg至1.0 mg/kg之间,患者体重范围为40–120 kg,则所需剂量在4 mg至120 mg之间,20–50 mg/mL的制剂可能比100 mg/mL的配方更合适。
三、给药装置相容性
在产品使用的过程中,配制溶液不可避免地会接触到各种给药组件。这些组件由不同于药品原包装的材料组成,均可能会影响产品的质量。
在实验室环境中测试每个组件是不实际的,因此可对接触材料进行测试,而不是单个组件。如果该药品溶液与所评估的材料类型兼容,则可使用该类别中的所有市售材料。观察到不相容性,则必须限制材料在临床研究中的使用。出于安全性考虑,大多数输液管路会配有过滤器,因此还要考虑蛋白质吸附、过滤器颗粒脱落和可浸出物等问题。建议在使用和不使用0.2μm和1.2μm过滤器的情况下对比研究。
与稀释剂配伍相容性研究类似,材料相容性评估的设计应涵盖最差的使用情况。评估还应包括对输液管路的最差条件模拟,例如,由于给药中断,给药溶液可以在输注管中停留的时间比预期的要长。目前,国内没有明确要求进行药液在输液管路中浸出物研究,但申报欧美则需评估给药装置的可提取物和浸出物。
四、气液界面剪切力
在使用过程中的各种操作步骤中都会引入空气-液体界面:在配制过程中或配制后旋转、倒转或摇晃药瓶,在配制剂量溶液时倒转或摇晃静脉注射袋,在运输过程中摇晃剂量溶液等等。表面活性剂如聚山梨酯20和聚山梨酯80通常被添加到蛋白质配方中,以保护蛋白质免受界面剪切力的影响,但配伍后其浓度可能会显著降低,需要在实验室做格外的研究。
评估临床使用中气液界面剪切力影响建议包括:如测试输液容器中最差条件下的装量(例如,静脉输液袋一半装量),评估搅拌和摇晃剪切力的影响,并测试临床方案中计划最小输注时间和最大流速。
五、模拟输液
模拟代表性成分和剪切应力条件,了解临床的输液装置非常重要,建议对可能使用的泵系统进行评估。大容量输液泵驱动系统通常使用容量为50–1000 mL的静脉输液袋,而注射泵驱动的输液系统使用容量为60 mL或更低的注射器。在临床I期研究中,为了能够在较宽的剂量范围内给药,可能需要使用注射泵。输液装置的选择通常由静脉输液袋中的最低稳定剂量溶液浓度决定。例如,如果最低稳定剂量的溶液浓度使得需要输注<25 mL的溶液,则可能需要使用注射泵。使用注射泵的最低输注量和流速需要通过与临床中心讨论。
六、临床使用中的储存条件和效期
临床使用中的储存条件和效期研究应包括所有储存条件下的测试,例如,对于需要在室温下输注数小时的产品,可考察在 2–8 °C 和 30 °C/75% RH 条件下0、4、8、24 小时评估药液稳定性。
对于冻干药物产品,须评估复溶后药液稳定性。例如,在室温/室光条件下暴露0、4、8、24小时,还应进行模拟输液研究,以评估给药结束前对产品质量影响。
微生物是确定储存条件和期限的一个重要因素。FDA及EMA相关法规均对临床药液配制及使用有严格要求。通常要求药液在4小时内药液配制和输液,如果规定在24小时内完成,则需要进行微生物挑战试验。
总结
临床配伍相容性研究应按照以上方法分阶段进行,这有助于确定临床预期使用过程。在后续的验证性研究中,应充分模拟最差条件以确保给药过程中产品的质量(见图2)。
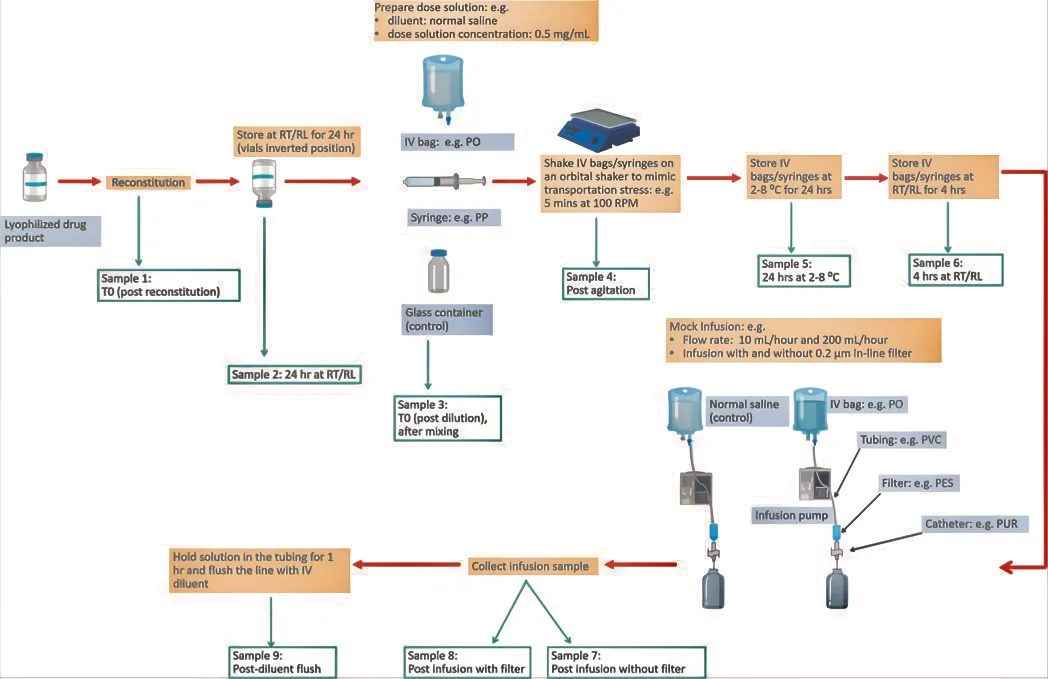
图2 冻干静脉注射产品的临床配伍相容性研究设计示例(静脉注射稀释液:0.9%生理盐水;剂量溶液浓度:0.5mg/ml;输注)
参考文件
1. Parenteral protein formulations:an overview of approved products within the European Union. Eur J Pharm Biopharm.2018;131:8–24.
2. Overcoming the challenges in administering biopharmaceuticals: formulation and delivery strategies. Nat Rev Drug Discov. 2014;13(9):655–72.
3. Guidance for Industry: dosage and administration section of labeling for human prescriptiondrug and biological products — content and format.
4. FDA 21 CFR 201.57(c)(3): dosage and administration.
5. Regulation (EU) No. 536/2014 of the European Parliament and of the Council of 16 April 2014 on clinical trials on medicinal products for human use, and repealing Directive 2001/20/EC.