在上篇“一文读懂污染控制策略(Contamination Control Strategy,CCS)”(点击详情)中主要介绍了CCS的法规要求及概念,本篇主要简述无菌药品的相关概念、CCS与无菌药品之间的联系以及CCS采用整体法在无菌药品中的应用。
“无菌药品”的相关概念
一、什么是无菌药品?
是指法定药品标准中列有无菌检查项目的制剂和原料药,包括无菌制剂和无菌原料药。——中国GMP附录1“无菌药品”(2010年版)
二、无菌药品按生产工艺如何分类?
无菌药品按生产工艺可分为两类:
最终灭菌产品(采用最终灭菌工艺)、
非最终灭菌产品(采用无菌生产工艺,如:除菌过滤工艺、无菌分装工艺)
三、“无菌”的概念?
了解了无菌药品的定义和生产工艺分类,还需要弄清楚无菌药品中的核心词“无菌”的含义,顾名思义,“无菌”:指无微生物的存在。
但在无菌药品生产过程中,可能存在下述情况:
1. 微生物生长特殊性:导致其无法均匀分布于药品中。
2. 取样局限性:无菌检查是抽样性检查,取样操作无法覆盖全部成品。(即使覆盖全部成品检查,也无法保证无菌检查过程不出现检查无效的可能性。)
3. 工艺风险性:任何形式的最终处理(最终灭菌工艺、除菌过滤工艺、无菌分装工艺)均存在失败的可能。
结合上述,药品的无菌性绝不能只依赖于任何形式的最终处理或成品的无菌检查(即批次无菌药品的无菌检查结果合格不等同于此批次无菌药品的无菌性合格),故无菌药品中,“无菌”一词是相对无菌的概念。
四、无菌药品需要关注哪些污染?
1. 中国GMP(2010年版)附录1“无菌药品”第二章第三条:无菌药品的生产须满足其质量和预定用途的要求,应当最大限度降低微生物、各种微粒和热原的污染。
2. 欧盟GMP附录1(2022年版)2.1原则:The manufacture of sterile products is subject to special requirements in order to minimize risks of microbial, particulate and endotoxin/pyrogen contamination.(无菌产品的生产应符合一些特殊要求,以尽量降低微生物、微粒及内毒素/热原污染的风险)
结合上述法规的原则性要求,以及无菌药品中的生物制剂,还需考虑原液端的病毒污染控制,故无菌药品的主要污染控制对象(因病毒的特殊性,将其独立于微生物进行评价控制)可概述为:
微生物:细菌、霉菌、真菌、支原体等
热原:细菌性热原、内源性高分子热原、内源性低分子热原及化学热原
病毒:内源性病毒、外源性病毒
微粒:金属屑、玻璃屑、纤毛等
CCS与无菌药品
一、CCS与无菌药品的联系
01、在上篇“一文读懂污染控制策略(Contamination Control Strategy,CCS)”(点击详情)中,介绍了CCS的概念最早于2017年12月在欧盟GMP附录1《Manufacture of Sterile Medicinal Products,无菌药品生产》修订草案中首次提出,并于欧盟GMP附录1(2022年版)中正式提出,文中“范围”指出:The intent of Annex is to provide guidance for the manufacture of sterile products.Where a manufacture elects to apply guidance herein to non-sterile products,the manufacturer should clearly document which principles have been applied and acknowledge that compliance with those principles should be demonstrated.(附录是为无菌药品的生产提供指导。如果药品生产厂家选择将本指南应用于非无菌产品,生产厂家应明确记录哪些原则已被应用,并认可和证明符合这些原则)
02、同时检索欧盟GMP附录1(2022年版)《Manufacture of Sterile Medicinal Products,无菌药品生产》中的CCS一词,显示指南中出现51次,可见其重要性。
03、PDA于2023年2月颁布的TR90《Contamination Control Strategy Development in Pharmaceutical Manufacturing,药品生产的污染控制策略开发》指出:The principles presented in this technical report can be applied more widely to any drug manufacturing or compounding process.本技术报告提出的原则广泛应用于任何药品的生产。(对CCS的应用范围做出明确的进一步延伸)
基于上述法规,可理解为:CCS概念的提出是为了指导无菌药品生产,而后随着CCS理念的发展,进一步延伸至任何药品(无菌药品、非无菌药品)。
二、CCS在无菌药品中的应用
下文从无菌药品的特殊性、污染对象以及产品工艺认识的角度,采用“整体法”策略,讲述CCS在无菌药品中的应用。
1. 基于对科学知识的认识,分析潜在污染
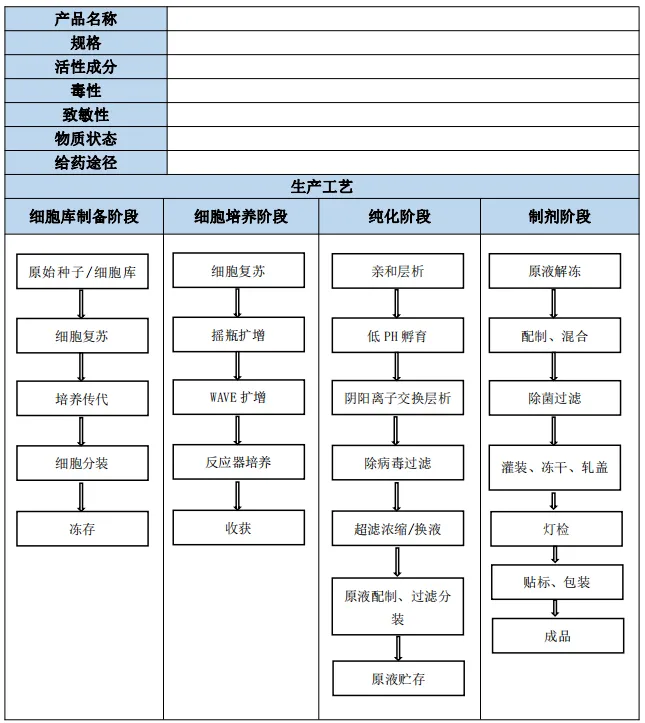
(1) 充分认识产品的特性及生产工艺,可以采用下表一所示方式进行梳理。
表一:产品特性及生产工艺信息表
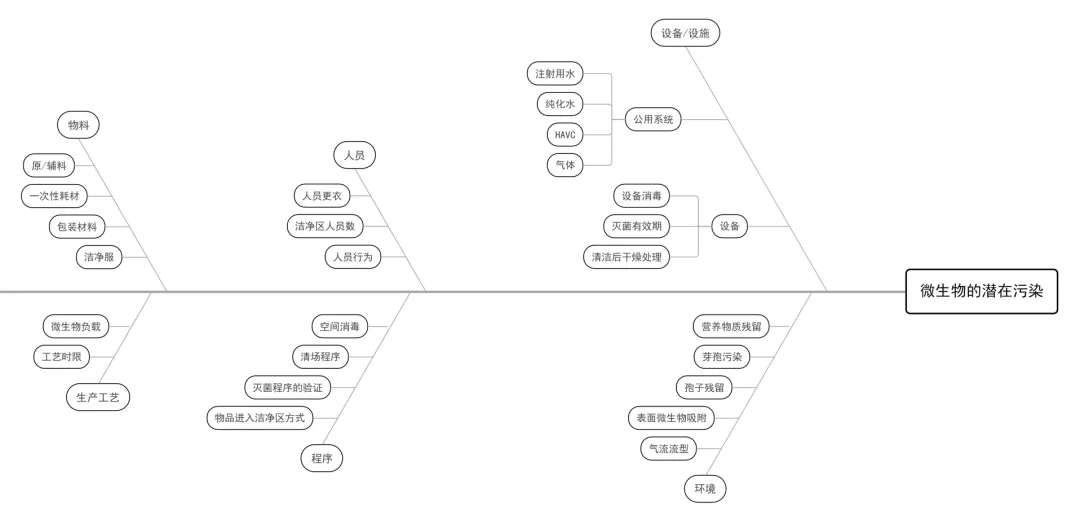
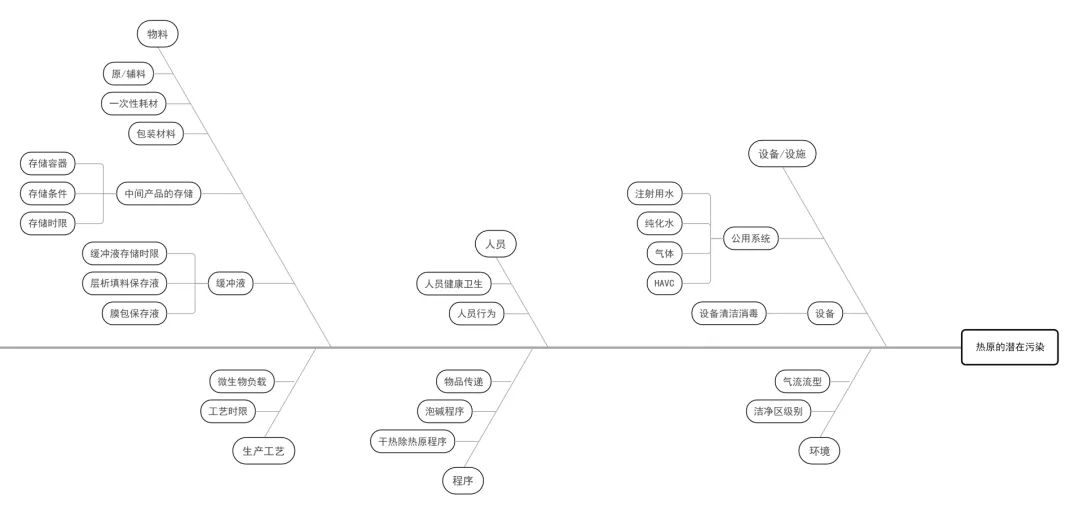
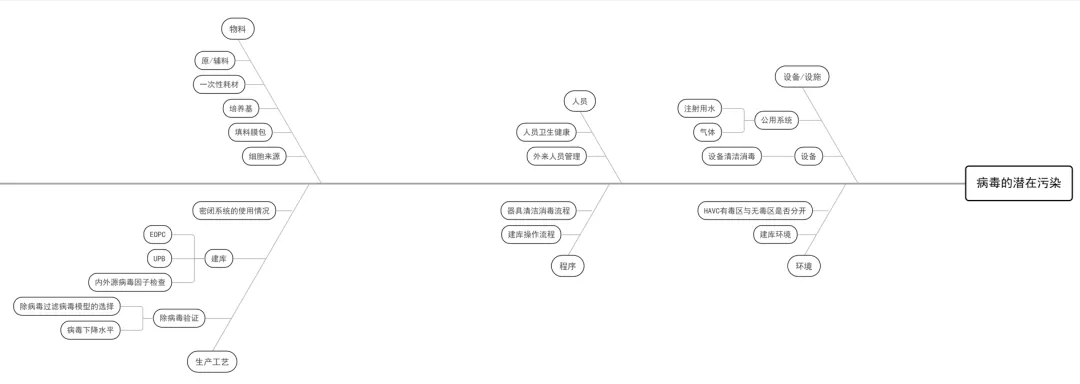
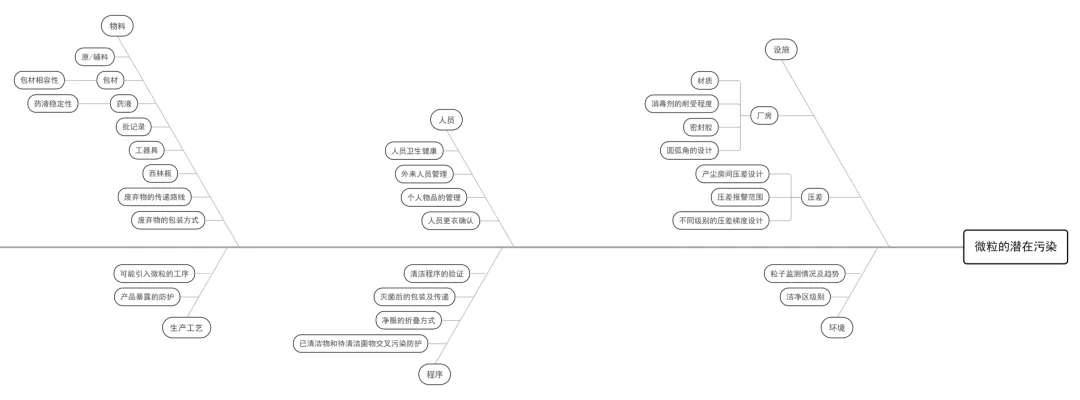
(2) 以无菌药品为被污染对象分析潜在污染,可以采用鱼骨图(石川图)或思维图的方式列举。下面就采用鱼骨图,分析生产中的风险点,以无菌药品四个主要污染控制对象(微生物、热原、病毒、微粒)进行列举分析,分别见下图:
图一:微生物潜在污染分析鱼骨图
图二:热原潜在污染分析鱼骨图
图三:病毒潜在污染分析鱼骨图
图四:微粒潜在污染分析鱼骨图
2. 评价潜在污染的风险状态,进行差距分析
(1) 分析了上述潜在污染后,需要组建检查小组(小组成员需涵盖各个系统、板块的人员以及微生物专家)。
(2) 检查小组对潜在污染进行评价及差距分析(主要评价两方面:是否有措施控制?措施控制的效果如何?)。
3. 开展污染控制对象的风险评估
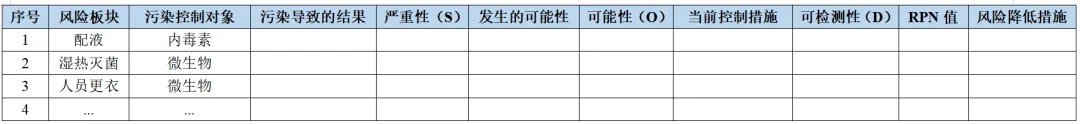
(1) 基于上述评价及差距分析给出结果,开展污染控制对象的风险评估,可采用FEMA的形式进行,进而采取适当的风险降低措施,具体形式可参考下表二:风险评估模板。
表二:风险评估模板
4. 编写污染控制策略(CCS)文件
(1) 依据上述风险评估所输出的风险降低措施,编写各车间或板块的CCS文件。
(2) 各车间或板块的CCS文件应该是整体CCS的一部分,需关联纲领性的CCS主文件。
5. 落实定期回顾、评价及优化污染控制策略(CCS)的要求
(1) 周期性回顾及评价:于每份CCS文件中规定回顾评价的周期(如:半年一次、一年一次)。
(2) 特殊性回顾及评价:
新产品引入、共线生产情况(也可在新产品引入风险评估、共线风险评估中说明,但需关联车间CCS文件);
生产工艺变更;
车间改造;
公用系统重大维修。
(3) 必要时,输出相应的CAPA。
结束语
CCS是以科学知识为基础,风险评估为工具来进行编制,其实施则依靠具体的文件和数据分析。CCS不是一次性的风险评估行为,是通过持续地回顾评价,以达到优化提升的动态行为。
需要注意的是:输出一个更好的CCS不是最终的目的,得到一个更好的无菌保证水平和质量管理体系才是核心目标!
参考文件
1. 中国GMP附录1“无菌药品”(2010年版)
2. 中国GMP指南(2023年版)
3. ICH Quality Guideline Q9:Quality Risk Management.
4. PDA Technical Report No.90:Contamination Control Strategy Development in Pharmaceutical Manufacturing.
5. EU Guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use,Annex 1:Manufacture of Sterile Medicinal Products.(2022)