1983年Smith和 Summers等人使用苜蓿银纹夜蛾多角体病毒(AcMNPV)感染草地贪夜蛾细胞(Sf9细胞)获得重组蛋白人干扰素 β(IFN-β)
[1]。后来 Maeda 等又用家蚕核型多角体病毒(BmNPV)为载体表达了人干扰素 α(IFN-α)
[2]。证明了利用携带外源基因的杆状病毒为载体在昆虫细胞中表达外源基因的技术是可行的。随着现代分子生物学和细胞培养技术的不断进步和发展,昆虫细胞-杆状病毒表达载体系统应用到重组病毒,重组蛋白等各个领域,现如今已经和细菌、酵母、哺乳动物细胞构成四大重组蛋白表达系统。
图1.四大蛋白表达系统(图片来源于网络,侵删)
与其他表达载体系统相比,昆虫细胞杆状病毒表达载体系统具有以下优点[1][3]:
1. 安全性。杆状病毒基本上对哺乳动物和植物无致病性。它们的宿主范围有限,通常仅限于特定的无脊椎动物物种。主要感染鳞翅目昆虫幼虫(蝴蝶和飞蛾)。
2. 易于放大。杆状病毒已被可重复放大,用于大规模生产具有生物活性的重组产品。
3. 高水平的重组基因表达。在许多情况下,当宿主蛋白合成减少时,重组蛋白是可溶性的,并且很容易在感染后期从感染细胞中回收。
4. 翻译后修饰充分。借助昆虫细胞宿主繁殖,昆虫宿主以类似于哺乳动物细胞的方式对外源蛋白磷酸化、糖基化和信号肽切除等的修饰与天然蛋白的情况相似,从而生物学活性得到提高
[9]。
5. 悬浮培养的细胞系。昆虫细胞可在无血清培养基中进行悬浮培养,容易实现大规模的低成本生产。
6. 基因容量大。能接受较大的外源基因的插入,最高可容纳 25 个外源 cDNA
[8],具有较好的可塑性,可在同一病毒载体上克隆多个外源基因及其调控元件,也能在同一昆虫细胞里同时表达多个外源基因。
一、重组杆状病毒的构建及表达
昆虫杆状病毒表达载体系统是以杆状病毒作为外源基因载体,以昆虫细胞作为宿主进行基因组自我扩增与目的蛋白的表达。构建重组杆状病毒的关键在于构建穿梭转移载体:将目的基因插入到 ph 或 p10 启动子下游的多克隆位点,因转移载体中含有与野生型杆状病毒进行重组的同源序列,所以转移载体与亲本病毒 DNA 进行重组时将获得携带有外源基因的重组病毒。
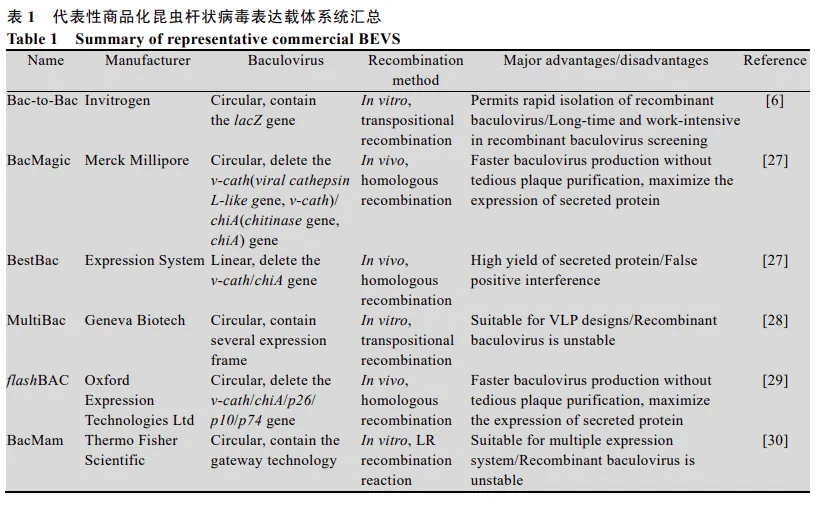
目前应用较为广泛的商品化昆虫杆状病毒表达载体系统类型多样,为提高分泌蛋白的表达量,研究人员陆续开始探索新的技术和应用。图2列举汇总了部分常用并且已优化的商品化表达载体系统
[5]。
图2.代表性商品化昆虫杆状病毒表达载体系统汇总
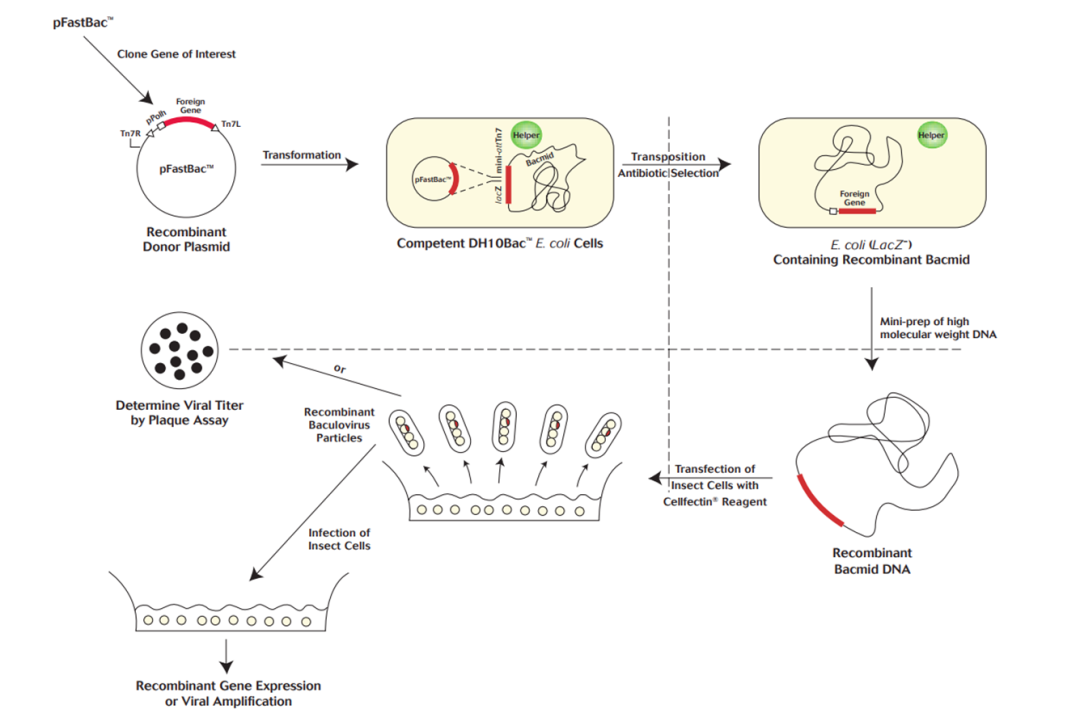
使用较多的系统例如Bac-to-Bac 系统如图3,通过穿梭质粒 (pFastBacTM)、辅助质粒 (Helper) 与杆状病毒穿梭载体 (Bacmid) 可在大肠杆菌中进行转座重组,将目的基因导入杆状病毒基因组中,随后再通过蓝白斑筛选技术得到正确的重组杆状病毒
[4]。
图3. 1993 年,Luckow 等发明了 Bac-to-Bac 表达系统,主要包含 pFastBac 供体载体和 DH10Bac 感受态细胞 2 种成分。在 Tn7 转座酶的帮助下,pFastBac 上的 Tn7 转座子会将外源的目的基因插到 Bacmid 中,病毒重组后破坏了感受态细 中的 lacz 基因,通过蓝白斑法能筛选出含重组病毒的单克隆细菌[4]。
Bac-to-Bac杆状病毒表达系统进行目的蛋白表达的实验步骤概述
(1) 把目的基因克隆至pFastBac系列载体产生重组质粒。根据pFastBac系列载体的多克隆位点选择合适的酶切位点,按照读码框插入待表达的目的基因序列。
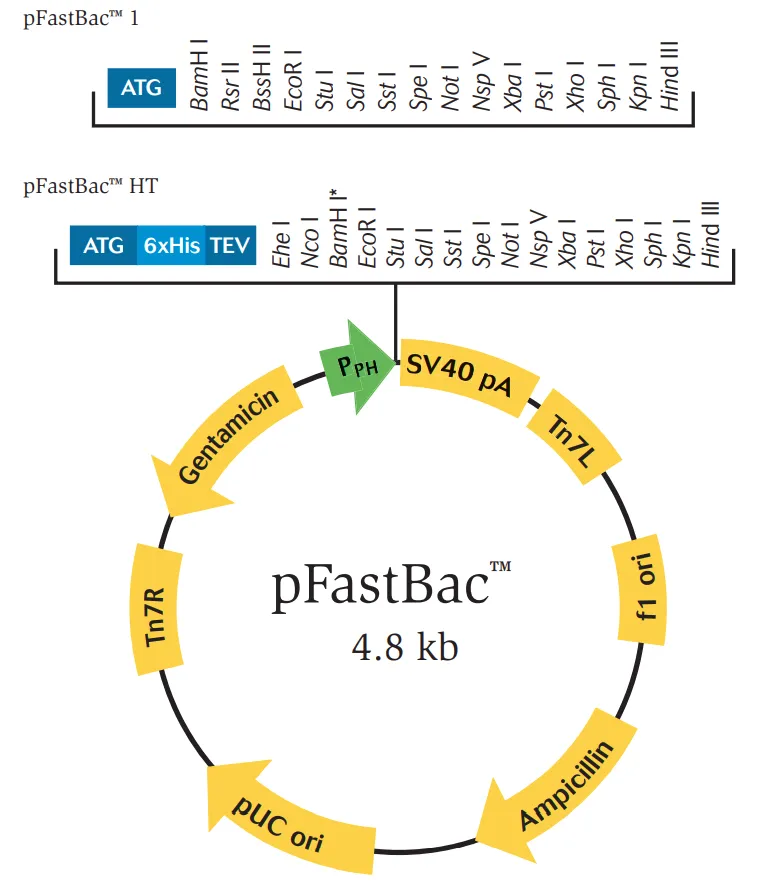
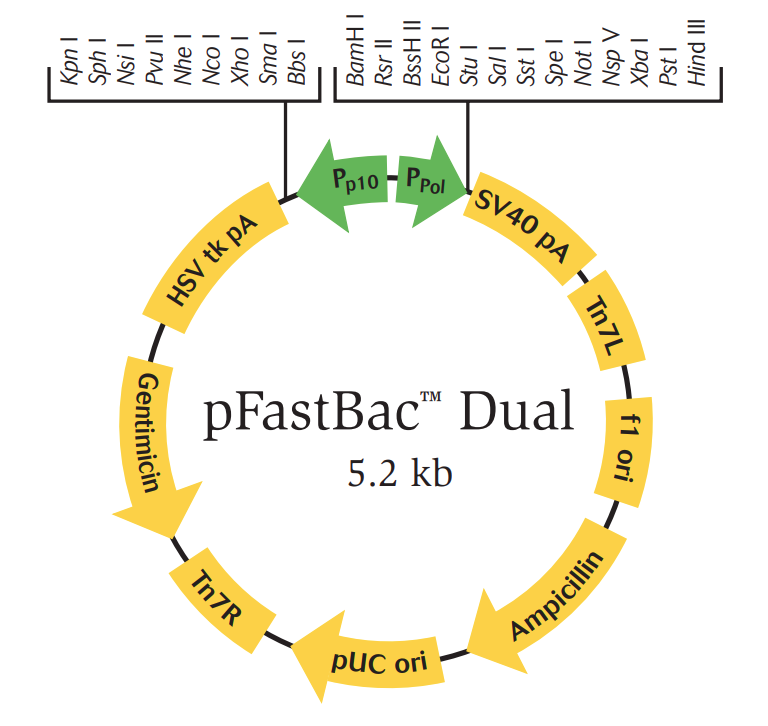
图5. pFastBac™ 1 具有高水平的强启动子,用于简单克隆的大量克隆位点。pFastBac™ HT载体提供了强大的多面体启动子以及N端6xHis标签,用于重组蛋白的简单纯化。该载体还包含TEV蛋白酶切割位点,用于在蛋白质纯化后去除组氨酸标签。
pFastBac™ Dual是一个单一载体,具有两个强启动子,即多面体启动子和p10启动子,在一个单一的载体中同时表达昆虫细胞中的两种蛋白质。
(2)转化pFastBac重组质粒到DH10Bac大肠杆菌中,37℃培养48小时,形成蓝白斑。转化后利用蓝白斑筛选重组菌株。重组菌株由于转座会导致LacZ基因的破坏而呈现白斑。
(3)挑取白斑,使用含有抗性的LB培养液,培养过夜。
(4)小量抽提试剂盒提取重组bacmid DNA,将提取的质粒保存至4℃。
(5) 重组bacmid的PCR鉴定。
(6) 重组bacmid转染昆虫细胞。选择处于对数生长期的昆虫细胞,细胞活率大于90%。将重组bacmid转染进入昆虫细胞,转染后,28℃培养24小时,细胞和细胞核开始变大;转染后24-72小时,细胞慢慢停止生长、脱落,细胞表面长出芽孢状结构;转染后72小时候细胞开始裂解,此时病毒开始释放到培养液中。
(7)收集培养液上清。转染96小时后,收集上清,500g离心5分钟以沉淀细胞和细胞碎片,取上清即为P1代杆状病毒。此时病毒滴度通常为1X106-1X107pfu/ml。P1代病毒可短期保存于4℃。
(8)P1代杆状病毒的扩增:P1代病毒再次感染昆虫细胞可获得P2代病毒。28℃培养48-72小时后,70-80%的细胞死亡时,收集细胞和上清,500g离心5分钟,取上清即为P2代病毒。此时病毒滴度约为1X107-1X108pfu/ml。
(9)P2代病毒感染昆虫细胞后再次扩增,最终会获得滴度更高的P3代病毒。
(10)使用P3代病毒感染昆虫细胞进行目的蛋白的大规模表达。可选择Sf9/Sf21/HighFive的任何一种细胞株进行蛋白大规模表达。但如果表达的是分泌蛋白,建议选用HighFive。建议在昆虫细胞的对数生长期进行病毒感染,此时细胞密度在1X106/ml -2X106/ml为佳,MOI可从5-10开始尝试。
二、昆虫杆状病毒载体表达系统的应用
2009 年美国食品药品监督管理局(FDA)批准了葛兰素史克(GlaxoSmithKline,GSK)人乳头瘤状病毒(HPV)疫苗Cervarix
®的上市,这也是第一个利用昆虫杆状病毒表达系统生产上市的人用疫苗,其主要成分是由16、18 型HPV 的L1 蛋白组成的病毒样颗粒
[6]。随后在2013年Protein Sciences生产的一款基于杆状病毒表达系统开发并商业化的创新性三价流感疫苗——Flublok
®也通过了FDA批准,用于19至49岁人群季节性流感的预防,这也是利用 BEVS 生产亚单位疫苗的成功代表
[7]。
图6. Cervarix®和Flublok®
1.促进AAV治疗药物的发展
基于BEVS表达载体系统的优越性,2023年2月20日,欧盟委员会批准了AAV基因疗法Hemgenix(etranacogene dezaparvovec)有条件上市许可,用于治疗没有使用过凝血因子Ⅸ抑制剂的中度和重度B型血友病成人患者。这也是全球第三款昆虫系统AAV药物,此前2022年11月Hemgenix在美国批准上市,售价350 万美元,被评为世界上最昂贵的药物。由于应用最为广泛的HEK293系统在生产AAV治疗药物的产能上难以逾越200L放大产线,而昆虫细胞sf9系统由于其易于放大生产的优点,在AAV药物生产中极具应用潜力。
2.治疗I型糖尿病
I型糖尿病作为一种自身免疫性疾病,其中的谷氨酸脱羧酶是主要的在研靶点目标。2005 年,Diamyd公司以人 GAD65 与氢氧化铝联合使用的方式治疗成年型糖尿病,结果表明由 BEVS 生产的 GAD65 具有很好的安全性并能有效缓解人体内 C 肽的释放
[10]。
3.抑制呼吸道合胞病毒在肺部的扩增
呼吸道合胞病毒(RSV)是诱发呼吸道疾病的主要病原体之一。2012 年,Novavax 公司利用 BEVS 表达出 RSV外壳表面的 Fusion 糖蛋白,蛋白颗粒疫苗候选物在棉鼠动物模型上证实了此疫苗能诱发机体产生 IgG 型中和抗体,此外还能有效抑制 RSV 在肺部的扩增,并且在后续的I期临床实验中表明Fusion 糖蛋白无明显不良症状
[11]。
4.兽用疫苗和药物
重组杆状病毒在昆虫细胞内表达的外源蛋白几乎都是可溶性的,在抗原性和免疫原性非常接近天然来源的分离物。利用其优势,可以开发各种动物疾病的诊断药试剂盒,2006 年勃林格殷格翰公司首次推出猪圆环 2 型病毒载体灭活疫苗,于 2010 年获农业部批准引入,成为国内第一个针对猪圆环病毒感染的疫苗。在禽流感疫苗研究方面,Rezaei 等将重组有禽流感病毒 H1N1、H3N2HAs 和 M1 基因的杆状病毒共同转染昆虫细胞,免疫小鼠后攻毒,与对照相比,免疫小鼠并未出现死亡等其他反应
[12]。
5.亚单位疫苗研究
在后续流感疫苗的生产研究上,针对禽流感病毒H6N1,Hsieh等通过使用pFastBacTM 载体与DH10Bac 细胞获得了可进行 H6N1 毒株 HA1 分泌表达的重组杆状病毒,并证明了细胞培养物和幼虫中表达的蛋白成分可以作为有效的亚单位疫苗产生抗HA1的抗血清
[13]。
随着昆虫细胞杆状病毒载体系统的不断完善和进步,在生物医药飞速发展的今天,因其表达效率高,表达蛋白的修饰过程安全性好,对人类没有致病性等优点,极大的促进了蛋白的结构和功能研究,在疫苗生产、靶向治疗、基因治疗、生物防治等领域都具有广阔的应用前景。为了更好的适应后续的研究与生产,需要技术不断进步,期待BEVS能够借助其独特的优势为人类和动物健康做出更多贡献。
参考文献
[1] Production of human beta interferon in insect cells infected with a baculovirus expression vector[J]. Mol Cell Biol,1983,3(12):2156-2165.
[2] Production of human alphainterferon in silkworm using a baculovirus vector[J].Nature, 1985,315(6020):592-594.
[3] Recombinant expression and reconstitution of multiprotein complexes by the USER cloning method in the insect cell-baculovirus expression system. Methods, 2016, 95: 13–25.
[4] Efficient generation of infectious recombinant baculoviruses by site-specific transposon mediated insertion of foreign genes intoa baculovirus genome propagated in Escherichia coli[J]. J Virol,(67):4566–4579.
[5] 荣芮, 李婷婷, 张玉云, 等. 昆虫杆状病毒表达载体系统在疫苗研究中的应用进展. 生物工程学报, 2019, 35(4): 577–588.
[6] Human papillomavirus and HPV vaccines: a review. Bull World Health Organ, 2007, 85(9): 719–726.
[7] FluBlok, a recombinant hemagglutinin influenza vaccine. Influenza Other Respi Viruses, 2008, 2(6): 211–219.
[8] biGBac enables rapid gene assembly for the expression of large multisubunit protein complexes. Proc Natl Acad Sci USA, 2016, 113(19): E2564–E2569.
[9]Insect cells as factories for biomanufacturing. Biotechnol Adv, 2012, 30(5): 1140–1157.
[10] GAD65 vaccination: 5 years of follow-up in a randomised dose-escalating study in adult-onset autoimmune diabetes. Diabetologia, 2009, 52(7): 1363–1368.
[11] Respiratory syncytial virus fusion glycoprotein expressed in insect cells form protein nanoparticles that induce protective immunity in cotton rats. PLoS ONE, 2012, 7(11): e50852.
[12] Cloning and kinetics of expression of Brucella abortus heat shock proteins by baculovirus recombinants[J]. Veterinary Microbiol,2000,75: 199 - 204.
[13] A secretary bi-cistronic baculovirus expression system with improved production of the HA1 protein of H6 influenza virus in insect cells and Spodoptera litura larvae. J Immunol Methods, 2018, 459: 81–89.