昆虫细胞杆状病毒表达系统(IC-BEVS)是一类应用广泛的真核表达系统,在高表达蛋白的同时,具有同大多数高等真核生物相似的翻译后修饰加工以及转移外源蛋白的能力。同时由于其不存在任何对哺乳动物有潜在威胁的动物病毒片段,自1983年引入BEVS技术以来,杆状病毒系统已成为用于重组蛋白表达的最通用、最强大的真核载体系统之一[1]。
杆状病毒的分类、结构表型和感染方式
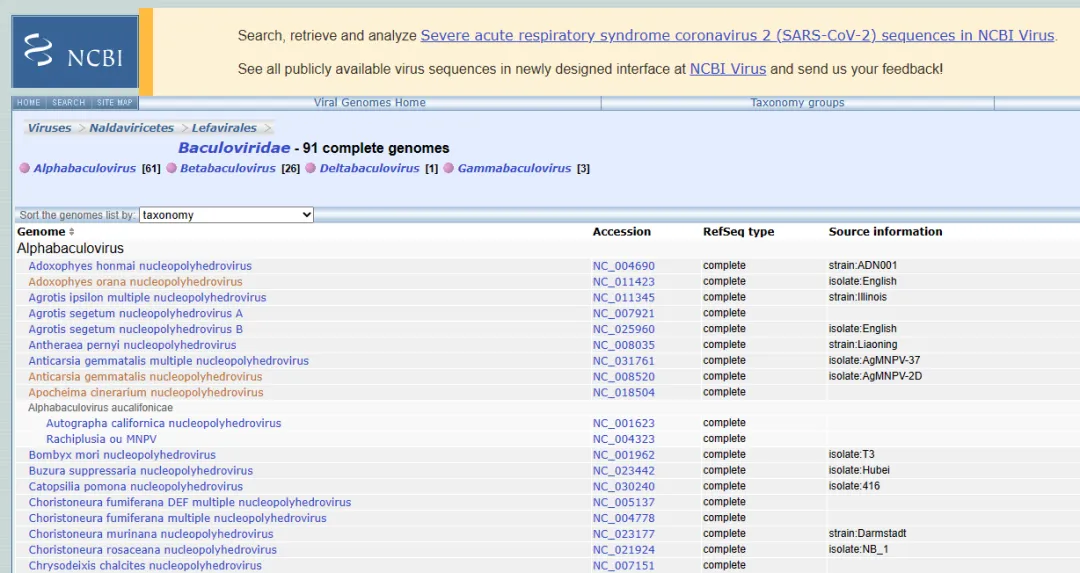
杆状病毒具有大的环状双链DNA基因组,其范围约为80至180kbp。杆状病毒科又分为四个属:α杆状病毒、β杆状病毒、δ杆状病毒和γ杆状病毒[2],见图1。
图1. NCBI网站查询的91种杆状病毒全基因组
杆状病毒已知的91种完全基因组中,α型杆状病毒属就有61种,因此病毒研究也最为深入,包括苜蓿核型多角体病毒(AcMNPV)、家蚕核多角体病毒(BmNPV)、黄杉毒蛾多核衣壳核多角体病毒(OpMNPV)、棉铃虫核型多角体病毒(HearNPV)等。从苜蓿环纹夜蛾中分离出的苜蓿核型多角体病毒(AcMNPV)是目前研究最为广泛的杆状病毒之一
[3]。
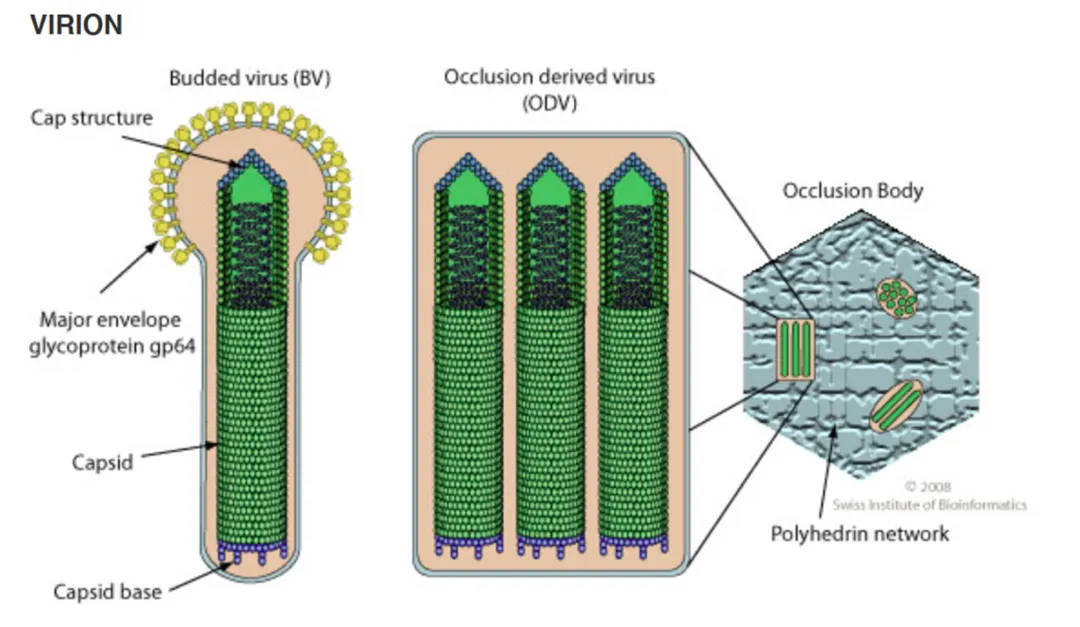
典型杆状病毒感染周期的一个显著特征是产生两种物理结构上不同类型的病毒粒子。一种病毒体表型被称为包涵体病毒(ODV),另一种被称为芽状病毒(BV)
[4],如图2。两种病毒的形成时间不同,BV在病毒复制的早期开始形成,含有单个核衣壳,外有GP64蛋白包被的囊膜,可以在昆虫体内进行细胞间传播。ODV在病毒复制的晚期开始形成,含有一个或多个核衣壳,外有一层蛋白质基质包被。
图2. 病毒粒子BV和ODV形态结构
在ODV病毒粒子的形态下,核衣壳在细胞核内获得包膜,随后病毒粒子被封闭或包裹在结晶的蛋白质基质中,形成封闭体(OB)。ODV病毒粒子在昆虫之间传播感染,特别容易感染昆虫中肠的上皮细胞。ODV感染中肠细胞后,BV病毒粒子从感染的中肠上皮细胞的基底表面出芽进入血腔,并在受感染的动物体内从细胞到细胞和从组织到组织系统地传播感染。对于AcMNPV等病毒,血腔内的大多数组织(气管上皮、血细胞、表皮、肌肉等)都会受到感染,并产生额外的BV,从而进一步在动物体内传播感染。BV 中有一种生物学功能较为突出的囊膜糖蛋白 Gp64,当杆状病毒通过质膜出芽时获得Gp64,缺失此蛋白时,将无法完成细胞间感染
[5]。
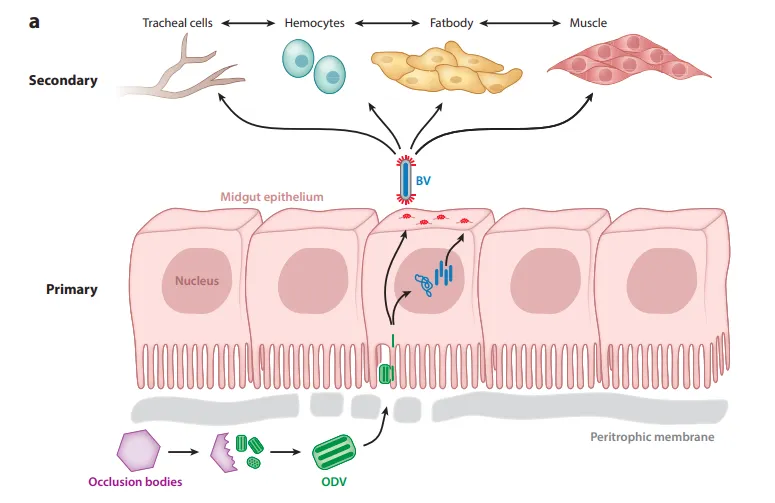
图3说明了杆状病毒粒子表型及其在宿主组织感染中的作用。解释了感染的初级和次级阶段。感染的主要阶段发生在闭塞体(OBs)在高pH分解并将包涵体(ODV)病毒粒子释放到中肠腔中。ODV病毒粒子穿过营养膜后,与中肠上皮极化上皮细胞的微绒毛结合并融合,将核衣壳释放到细胞质中。在病毒复制和核衣壳在细胞核中组装(或直接穿过)后,核衣壳被运输到基底质膜,在那里它们出芽以产生出芽病毒(BV)表型。BV病毒粒子可能直接感染一些细胞(气管细胞和血细胞),也可能在血淋巴中循环,感染其他组织,如脂肪体和肌肉。在感染的第二阶段,其他组织的感染导致额外BV的产生,从而进一步在动物中传播感染。ODV和OBs在所有细胞类型中产生,随后在细胞裂解和动物溶解或液化时释放
[4]。OBs是在动物感染后期细胞裂解时从感染细胞中释放出来的,通常,感染的昆虫会液化。这是一个由至少两种病毒编码的酶(几丁质酶和组织蛋白酶)介导的过程,它们催化昆虫外骨骼的分解把OBs释放到环境中,完成自然界的感染循环。
图3. 杆状病毒粒子表型及其在宿主组织感染中的作用
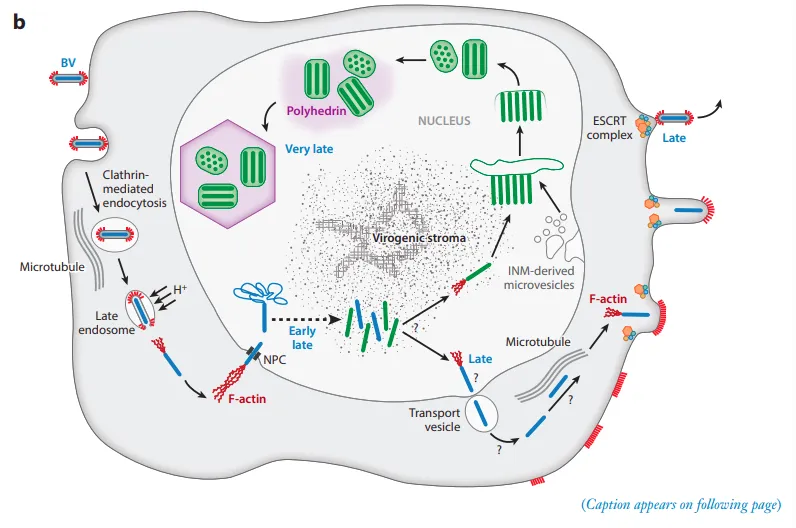
图4展示了杆状病毒在非中肠宿主细胞中的进入、复制和排出。该图表示被α杆状病毒BV感染以及随后BV和ODV的病毒复制和产生。在BV结合并通过网格蛋白介导的内吞作用进入后,沿着微管运输,并且在酸化后,核衣壳(蓝色)被释放。P78/83 Arp2/3复合物的聚合导致肌动蛋白的启动,肌动蛋白启动为在细胞质中运输核衣壳和穿过核孔提供了推进力。核衣壳在细胞核中的释放导致病毒基因表达、DNA复制和子代核衣壳(蓝色和绿色)在病毒基质中的组装。在核衣壳中,一些被标记为从细胞核排出(蓝色),另一些被标记用于ODV产生(绿色)。在细胞质小泡(运输小泡)中观察到离开细胞核的核衣壳,这些小泡将核衣壳释放到细胞质中
[4]。
图4. 杆状病毒在非中肠宿主细胞中的进入、复制和排出
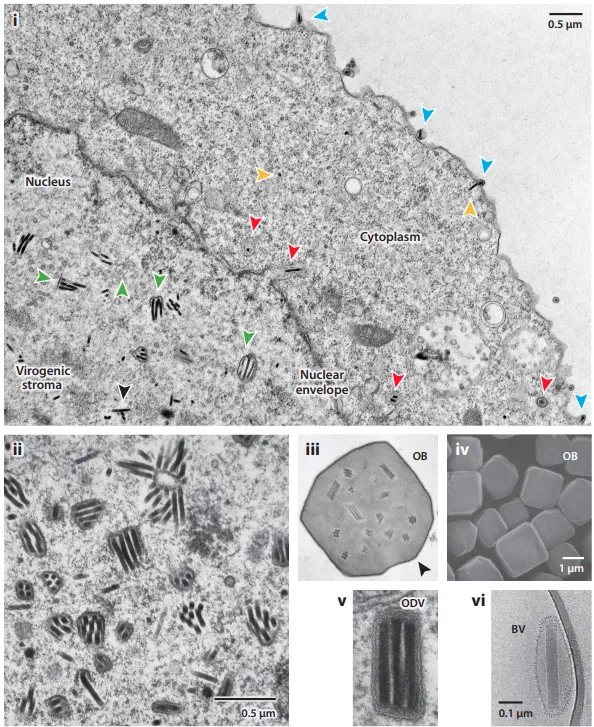
此外,ODV病毒粒子对昆虫中肠细胞的感染具有高度的特异性,必须克服显著的物理和生物障碍。另外ODV在环境中的稳定性严重依赖于OB蛋白,OB蛋白围绕并保护ODV病毒粒子免受干燥和可能的紫外线灭活。OB蛋白(在大多数杆状病毒中称为多角体蛋白)在OB中形成天然晶体,在该结构中,多面体三聚体通过二硫键连接,形成十二聚体。图5是AcMNPV复制和病毒粒子表型的电子显微照片。
图5. AcMNPV复制和病毒粒子表型的电子显微照片。
在细胞培养系统中,感染是由BV病毒粒子引发的,因为ODV病毒粒子在培养细胞中的传染性很差,感染通常在幼虫中进行。所以ODV在细胞培养中不具有感染性,在体外培养的同时也不需要多角体蛋白质结晶的保护
[6]。
昆虫细胞系培养及特点
在过去的几十年里,已经从6个种属的100多种昆虫中分离出数百种昆虫细胞系
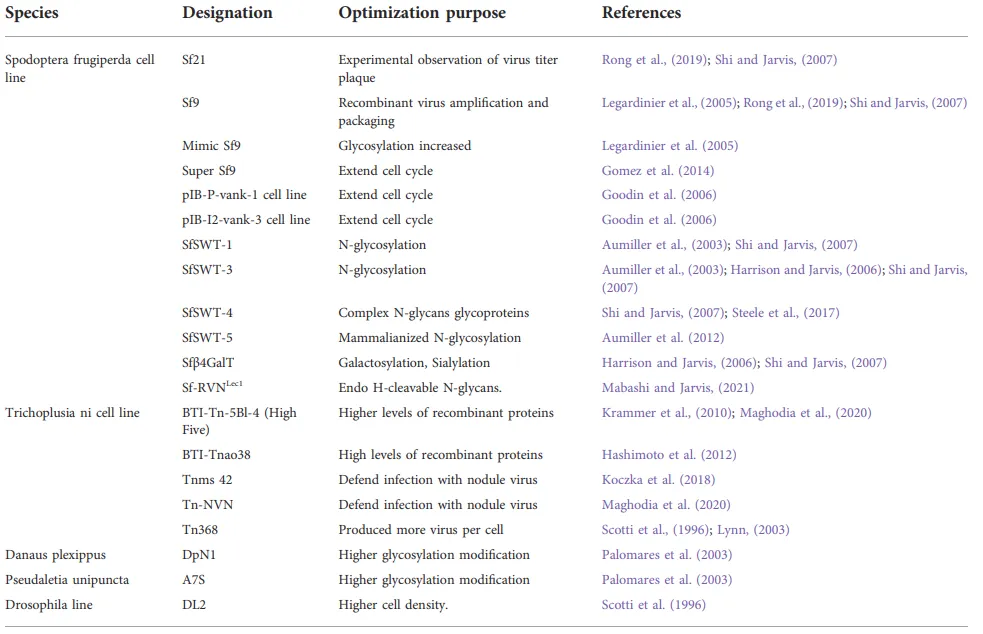
[7]。鳞翅目细胞系主要与BEVS一起用于重组蛋白的表达和杆状病毒生物杀虫剂的生产,特别是来自家蚕、芸苔、草地贪夜蛾和毛滴虫属的细胞系。其中,Sf-9、Sf-21、Tn-368和High Five是在工业应用中应用最广泛的细胞系。这些细胞系和相关细胞系高度易受加利福尼亚体多核多角体病毒(AcMNPV)和其他杆状病毒的感染。图6例举了部分常用的工程细胞系以及适用的方向
[8]。
图6. 常用的工程细胞系以及适用的方向
Sf-21细胞系
第一个被广泛用于研究和技术应用的细胞系是Sf-21,这是一种由Vaughn及其同事于1977年建立的草地贪夜蛾S.frugiperda的卵巢细胞系,同时也是Sf-9细胞的克隆母系[9]。Sf-21细胞系研究的样本可以达到比较均一性,通过细胞培养一定代数后,所得到的细胞系则可以达到均一性而属于同一类型的细胞。
Sf-9细胞系
Sf-9细胞是源于雌性草地贪夜蛾蛹的卵巢组织,可以更好的用于复制杆状病毒表达载体。Sf-9细胞系来源于Sf-21,是由Sf-21的克隆株筛选而来,与Sf-21相比,Sf-9对PH、渗透压和剪切力的耐受性更好。Sf-21和Sf-9细胞系适用于杆状病毒的感染、纯化、高滴度病毒的生产和表达重组蛋白。Sf-9细胞的生长和感染特性注定它在杆状病毒的转染与扩增方面表现出色,并且Sf-9细胞系体积较小,大小规则,易于形成单层和铺培养板。
Tn-368细胞系
Tn-368和High Five都是来源于粉纹夜蛾(Tn)的细胞系,然而有研究发现High Five细胞可被诺达病毒(nodavirus)隐性感染,而且杆状病毒感染High Five细胞可以刺激诺达病毒的病毒粒子的产生。
High Five细胞系
Tn-368和High Five都是来源于粉纹夜蛾(Tn)的卵巢组织。重组蛋白表达方面,High Five细胞系表达量更高,表达某些蛋白时甚至是Sf-9细胞表达的20倍以上。High Five的糖基化和磷酸化修饰比Sf9更复杂,因此更适合表达一些分泌性重组蛋白。人乳头瘤病毒的病毒样颗粒疫苗就是在High Five细胞中产生的。High Five细胞系表达重组病毒性能优越,经常用于转染和空斑纯化。
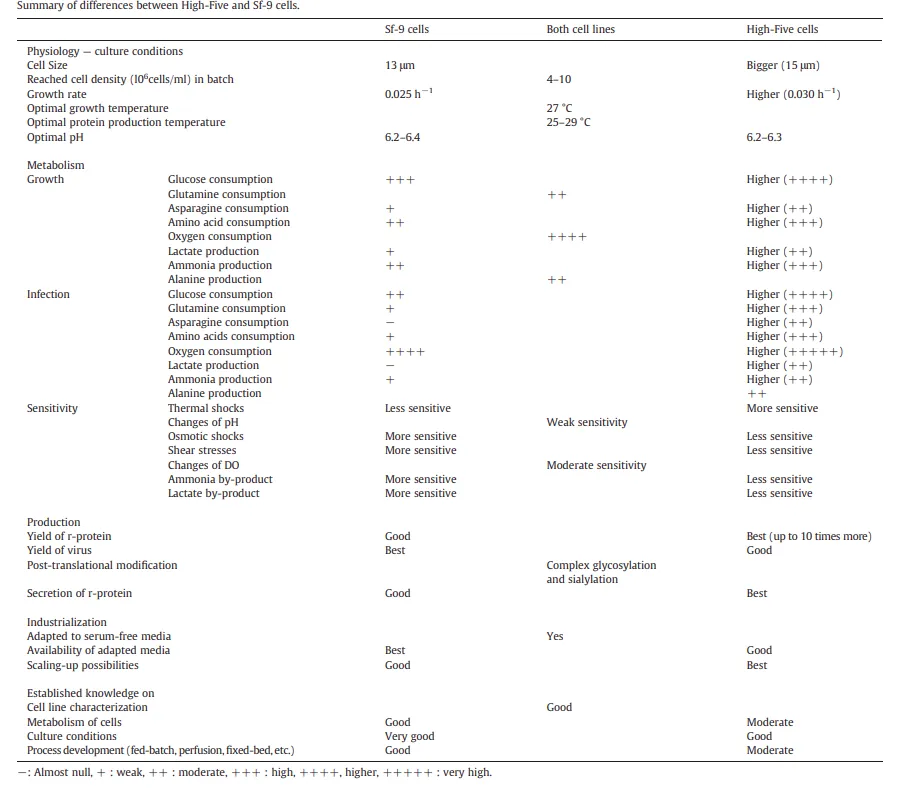
与Sf细胞系相比,High Five细胞系从一开始就显示出优越分泌糖蛋白生产的能力。图7总结了Sf-9和High Five细胞系的一些关键特性
[7]。
图7. Sf-9和High Five细胞系的一些关键特性
比较发现
01. Sf9 细胞更适合于重组病毒扩增及包装;Sf21 因细胞直径更大,更适用于病毒滴度空斑实验观察;High five细胞更适用于分泌蛋白表达。
02. Sf9 细胞对渗透压、剪切力和pH的耐受性比Sf21细胞更强,在转染与生产高滴度杆状病毒上表现出色。
03. High Five细胞比Sf9细胞增殖时间更短,表达量更高,其表达的蛋白在糖基化修饰方面比Sf9细胞更复杂。Sf9和High Five细胞具有悬浮和贴壁生长的特性,因此能通过摇瓶和生物反应器来大规模生产重组蛋白。
Sf细胞系适用于悬浮培养,并且在没有胰蛋白酶化的情况下通过适当的搅拌很容易从培养表面分离。Tn细胞系最初依赖于贴壁,但今天它们已经很好地适应了悬浮培养。Sf-21比Sf-9更脆弱,对渗透、pH和剪切应力的耐受性不如Sf-9,并且生长速率更低。如今,由于其生长和感染特性,Sf-21的使用已经减少。
High Five是一种昆虫细胞系,通常产生更多的重组蛋白,与Sf-9相比高出20倍。High Five细胞比Sf-9更能抵抗剪切应力和搅拌。High Five细胞比Sf-9细胞更大,蛋白质含量更高,其细胞大小分布比Sf-9细胞更广。然而,细胞大小取决于介质渗透压、剪切应力、细胞状态(存活、凋亡等)。近年来,由SF-9细胞衍生的固有细胞系express SF+(SF+)的优越特性促使其在几种生物制品的生产中使用,例如流感疫苗FluBlok。
参考文献
[1] Production of human beta interferon in insect cells infected with a baculovirus expression vector.Mol Cell Biol. 1983;3(12):2156-65.
[2] The interaction between baculoviruses and their insect hosts.Dev Comp Immunol.2018;83:114-123
[3] 凌同,余黎,白慕群.昆虫杆状病毒表达系统的研究进展与应用[J].微生物学免疫学进展,2014,42(02):70-78.
[4] Baculovirus Entry and Egress from Insect Cells.Annu Rev Virol. 2018;29;5(1):113-139.
[5] 冯敏, 吴小峰. 昆虫杆状病毒囊膜蛋白GP64与宿主细胞表面因子互作的研究综述. 蚕业科学, 2014, 40(5): 911–916.
[6] An Overview of Cell Culture Engineering for the Insect Cell-Baculovirus Expression Vector System (BEVS). Animal Cell Culture. 2015. 9: 501-515.
[7] Insect cells as factories for biomanufacturing.Biotechnol Adv. 2012;30(5):1140-57.
[8] Genetic engineering of baculovirus-insect cell system to improve protein production.Front Bioeng Biotechnol. 2022;20;10:994743.
[9] The establishment of two cell lines from the insect Spodoptera frugiperda (Lepidoptera; Noctuidae).In Vitro. 1977;13(4):213-7.